키트루다, 비소세포폐암 1ㆍ2차 치료제로 모두 사용 가능한 최초이자
현재까지 유일한 면역항암제1
KEYNOTE-024 등의 연구 통해 혁신성 인정, PD-L1 발현율 통한 적합 환자 선별 중요
한국 MSD(대표 아비 벤쇼산)는 지난 4월 7일 더 플라자호텔 루비홀에서 자사의 항 PD-1 면역항암제 키트루다의 비소세포폐암 1차 적응증 확대를 기념하는 기자간담회를 가졌다. 간담회에서는 키트루다의 적응증 확대 의미 및 폐암 치료에서 PD-L1 발현율의 중요성과 동반진단 필요성에 대해 발표했다.
키트루다는 올해 3월 국내 식품의약품안전처로부터 PD-L1 발현율이 50% 이상이며, EGFR 또는 ALK 변이가 없는 진행성 비소세포폐암 환자의 1차 치료제로 적응증을 확대 승인 받았다. 또한 백금 기반 항암화학요법 치료 도중 또는 이후에 진행이 확인된 진행성 비소세포폐암의 경우, 투여 대상이 PD-L1 발현 양성(TPS 1% 이상)으로 확대됐다.2 지난해 4월 백금 기반 항암화학요법 치료 도중 또는 이후에 진행이 확인된 진행성 비소세포폐암(PD-L1≥50%) 및 흑색종 1차 치료 승인을 받은 지 1년여 만의 성과다.
이로써 키트루다는 비소세포폐암에서 1ㆍ2차 치료제로 모두 사용 가능한 유일한 면역항암제가 됐다.1
이번 기자간담회에서 한국MSD 의학부 김영민 이사는 ‘폐암 치료의 역사와 키트루다 적응증 확대 의의’ 발표를 통해 “폐암 치료는 EGFR 발견을 시작으로 지난 수십 년에 거쳐 진화해 왔으나, 그 동안 치료법에 있어 많은 진전이 없었던 EGFR, ALK 유전자 변이가 없는 환자들에서 키트루다의 1차 치료제의 승인은 폐암 치료 역사에 한 획을 긋는 주요한 발전 중 하나”라고 설명하며 “키트루다는 새로운 기전과 PD-L1 발현율을 통한 보다 정밀한 접근 방법으로 과학적 혁신성을 인정 받았고, 임상 결과를 통해 지속적이고 우수한 효과를 인정 받았다”고 말했다.
연세암병원 종양내과 조병철 교수는 ‘면역항암제의 폐암 1차 승인에 대한 의의와 임상 사례’를 주제로, 키트루다의 폐암 1차 적응증 확대 기반이 된 임상 연구 및 실제 환자 사례를 소개하는 시간을 가졌다.
조병철 교수는 “지난 수십 년간 EGFR 또는 ALK 변이가 없는 진행성 비소세포폐암 1차 치료에서 치료 옵션이 제한되어 있었고 그간 수많은 연구를 통해 이러한 환자 군에서의 대규모 임상 시험이 진행 되어 왔으나 그 효과를 입증하지 못했는데 키트루다의 1차 승인 소식은 상당히 고무적이어서 의료진과 환자들의 기대가 크다”며, “폐암은 국내 암 사망률 1위이자 5년 생존율이 가장 낮은 암 종 중 하나로 꼽히지만, 키트루다의 이번 승인으로 향후 폐암 생존율이 높아질 것으로 기대하고 있다”고 말했다.
이어 조교수는 적응증 확대 기반이 된 키트루다 임상연구(KEYNOTE-024)에 대해서 소개했다.
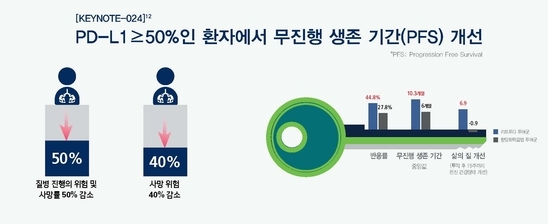
KEYNOTE-024는 편평세포와 비편평세포를 포함하는 진행성 비소세포폐암 환자 중 치료 경험이 없고 PD-L1 발현율이 높으며(TPS 50% 이상) EGFR 또는 ALK 변이가 없는 환자를 대상으로 진행된 연구다. 기존 표준 치료인 백금 기반 항암화학요법과 키트루다 단독 치료 요법 효과를 비교한 결과, 키트루다가 기존 표준 치료 항암화학요법 대비 질병 진행 혹은 사망의 위험을 50% (HR, 0.50 [95% CI, 0.37, 0.68]; p<0.001) 감소시켰고, 사망 위험은 40% (HR, 0.60 [95% CI, 0.41, 0.89]; p=0.005) 줄였다. 반응률의 경우, 키트루다 투여군이 44.8%(95% CI, 36.8 to 53.0)로, 27.8%(95% CI, 20.8 to 35.7)인 항암화학요법 투여군에 비해 높은 것으로 확인됐고, 치료제 관련 부작용 역시 더 적은 것으로 나타났다3.
조교수는 “KEYNOTE-024결과를 통해서도 알 수 있듯이, 폐암치료에서 PD-L1 발현율은 키트루다의 효과를 예측할 수 있는 가장 가능성 있는 예측 기준”이라며, “동반진단검사를 통해 폐암 환자의 PD-L1 발현율을 사전에 확인하면, 의료진은 키트루다에 효과를 보일만한 환자군을 미리 예측하여 처방할 수 있고 환자는 치료 옵션 선택에 현명한 결정을 할 수 있어 모두에게 긍정적인 의미가 있다”고 설명했다.
이날 한국 MSD 아비 벤쇼산 대표는, “한국의 폐암 환자들이 처음부터 혁신적인 치료를 받을 수 있게 되어 매우 기쁘게 생각한다”며, “MSD는 항상 환자를 중심으로 생각하며, 폐암으로 고통 받고 있는 많은 환자와 가족들의 치료제 접근성을 높여 하루 빨리 혁신적인 신약의 혜택을 볼 수 있도록 최선을 다할 것”이라고 밝혔다.
한편, 키트루다는 현재 30개 이상 암종에서 약 400건의 임상 연구를 진행하고 있다. 국내 식약처에는 비소세포폐암 1ㆍ2차, 흑색종에 허가를 받았으며2, 미국 식품의약국(FDA, Food and Drug Administration)에서는 비소세포폐암 1ㆍ2차, 흑색종, 두경부암과 더불어 최근 호지킨 림프종에도 승인 받은 바 있다4.
키트루다 임상시험에 대하여
[KEYNOTE-024]3
기존 치료 경험이 없고 PD-L1 발현율이 높은(TPS≥50%) 305명의 환자를 대상으로 표준 요법인 백금 기반의 2제 요법(페메트렉시드+카보플라틴, 페메트렉시드+시스플라틴, 젬시타빈+시스플라틴, 젬시타빈+카보플라틴, 파클리탁셀+카보플라틴)과 키트루다(200 mg, 3주 1회)의 효과를 비교하기 위한 무작위, 오픈 라벨 3상 연구이다. 기존 치료 경험이 없고 EGFR 또는 ALK 변이가 없으며, 동반진단 'PD-L1 1HC 22C3 PharmDx test'를 통해 PD-L1 발현율이 50% 이상인 환자를 대상으로 진행됐다. 해당 연구에서 환자 스크리닝 시 30.2% (n=500/1653)의 종양 샘플은 PD-L1 발현율이 50% 이상으로 확인됐다.
1차 유효성 평가 기준은 무진행 생존기간(PFS), 2차 평가 기준은 전체 생존기간(OS), 전체 반응률(ORR), 및 안전성(Safety)이었다. 연구 결과, 키트루다가 항암화학요법 대비 질병 진행의 위험 혹은 사망률을 50% 감소시켰고(HR, 0.50 [95% CI, 0.37, 0.68]; p<0.001), 사망 위험은 40% 줄였다.(HR, 0.60 [95% CI, 0.41, 0.89]; p=0.005) 반응률의 경우, 키트루다 투여군이 44.8%(95% CI, 36.8 to 53.0)로, 27.8%(95% CI, 20.8 to 35.7)인 항암화학요법 투여군에 비해 높은 것으로 확인됐고, 치료제 관련 부작용 역시 더 적게 나타났다.(73.4% vs 90.0%)
키트루다 제품 설명서
효능ㆍ효과
1. 흑색종: 수술이 불가능하거나 전이성인 흑색종의 치료.
2. 비소세포폐암
PD-L1 발현 양성(발현 비율≥50%)으로서, EGFR 또는 ALK 변이가 없는 진행성 비소세포폐암환자에서의 1차 치료
PD-L1 발현 양성(발현 비율≥1%)으로서, 백금 기반 화학요법제 치료 도중 또는 이후에 진행이 확인된 진행성 비소세포폐암의 치료. 다만 EGFR 또는 ALK 변이가 확인된 환자는 이 약을 투여하기 전에 이러한 변이에 대한 승인된 치료제를 투여한 후에도 질병의 진행이 확인된 경우여야 한다
References
2. KEYTRUDA 제품설명서
3. Martin Reck, Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer, The New England Journal of Medicine 2016: 11
4. 미국 KEYTRUDA 제품설명서