국내 출시 10주년 DPP-4 억제제 자누비아 조명 및
자누비아 25mg 신제품 출시 소개
세계적인 헬스케어 기업 머크(Merck & Co. Inc.)의 한국법인인 한국 MSD(대표 아비 벤쇼산)는 29일 플라자호텔(서울 중구 소재)에서 제 2형 당뇨병 치료제인 DPP-4(dipeptidyl peptidase-4) 억제제 자누비아(성분명: 시타글립틴)의 국내 출시 10주년 및 자누비아 25mg 출시를 기념한 기자간담회를 개최했다.
이번 간담회는 지난 2007년 9월 식품의약품안전처의 승인 후 지난 10년 동안 국내 제 2형 당뇨병 치료 발전과 함께 해온 자누비아의 효과와 안전성을 조명하고 오는 4월부터 새롭게 출시되는 자누비아 25mg를 소개하기 위해 마련됐으며, ‘제 2형 당뇨병 환자 치료의 패러다임 변화’를 주제로 가톨릭대학교 서울성모병원 내분비내과 윤건호 교수가, ‘신장애 동반 제2형 당뇨병 환자의 효과적인 치료 옵션 자누비아’를 주제로 한국MSD 의학부 이상진 이사가 주제 강연을 진행했다.
또한 부대프로그램으로 VR(Virtual Reality, 가상 현실) 기기를 통해 자누비아의 작용 기전 등의 콘텐츠를 체험할 수 있는 자누비아 VR 체험존도 운영됐다.
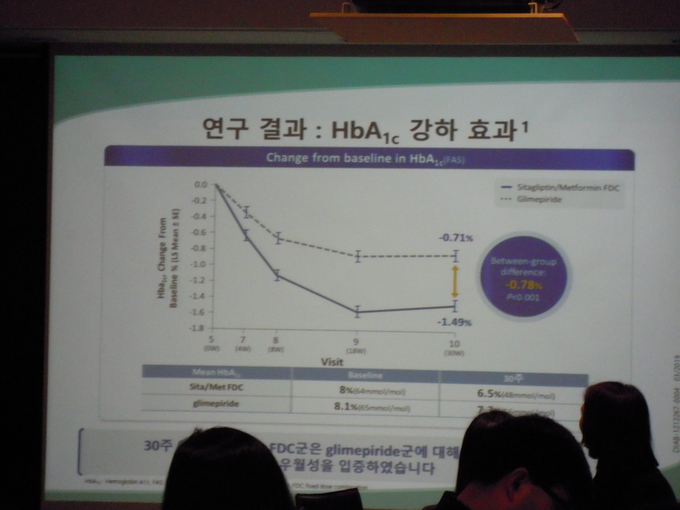
주제 강연을 통해서는 국내 제 2형 당뇨병 환자 대상으로 초기 치료 시 시타글립틴과 메트포르민 복합제인 자누메트와 글리메피리드 단독 투여 간의 효과와 안전성을 최초로 비교 평가한 연구 결과가 소개됐다.
연구 결과, 자누메트를 초기 요법으로 30주 동안 투여 시 글리메피리드 투여에 비해 통계적으로 유의하게 우월한 혈당 조절 효과(자누메트, 글리메피리드 투여 군에서 Least-Squares mean change from baseline, -1.49% vs -0.71%, Between-Group Difference: -0.78%(95%CI -0.96, 0.59), P<0.001)와 낮은 저혈당 발생(5.5% vs. 20.1%, p<0.001)을 나타냈다. 또한 안전성 평가를 위해 약물 투여 시의 체중 변화를 확인 결과, 자누메트 투여 군에서 0.83kg 감소, 글리메피리드 투여 군에서 0.90kg 증가한 것으로 나타났다(LS mean difference, 1.72kg; p<0.001).
한국MSD PC(Primary Care) 사업부 김소은 상무는 “국내 최초 출시 후 변함 없이 원외 처방액 1위a를 유지해온 DPP-4 억제제 브랜드 자누비아를 통해 지난 10년간 DPP-4 억제제가 제 2형 당뇨병 치료를 위한 효과적인 치료 옵션으로 자리매김하고 이로써 국내 제 2형 당뇨병 치료 발전에 기여해온 것에 보람과 자부심을 느낀다”며, “지난 10년간의 성과에 안주하지 않고 제 2형 당뇨병 치료 선도 기업으로서 앞으로도 국내 환자와 의료진이 제 2형 당뇨병을 효과적으로 관리하는데 힘을 보탤 수 있도록 최선을 다하겠다“고 말했다.
한편 한국MSD는 이번 행사를 통해 자누비아 25mg 출시를 발표했다. 자누비아 25mg은 혈액투석이나 복막투석을 요하는 말기신장애환자(ESRD, end-stage renal disease)를 포함한 중증 신장애 환자(크레아티닌청소율; CrCl <30 mL/min)에게 투여 가능하다. 이번 25mg 제형 출시로 자누비아는 모든 단계의 신장애 환자에게 처방이 가능해졌다.
TECOS 연구 참여 환자들을 대상으로 추정 사구체여과율(estimated glomerular filtration rate, eGFR) 기저 값에 따른 주요 심혈관계 사건 발생 및 만성 신장 질환 발생의 위험을 평가한 추가 하위 분석 연구 결과에서도 자누비아 투여는 추정 사구체여과율 기저 값에 근거한 신기능 수치에 따른 신질환의 단계와 관계 없이 주요 심혈관계 사건의 발생 위험을 높이지 않았으며(interaction p values were all >0.44), 또한 임상적으로 만성 신장 질환의 발생 위험도 증가시키지 않는 것으로 나타났다. 해당 연구는 2016년 12월 ‘Diabetes Care’ 학술지를 통해 발표됐다.
한국MSD 마케팅부 박도희 본부장은 “25mg 제형 출시로 중증 및 말기 신장애를 동반한 국내 제 2형 당뇨병 환자들도 필요 시 자누비아를 처방 받을 수 있게 됐다”며, “모든 단계의 신장애를 동반한 제 2형 당뇨병 환자에게서 처방이 가능해졌다는 점에서 의료진과 환자들이 자누비아를 통해 제 2형 당뇨병을 보다 효과적으로 관리하는데 기여할 것으로 기대한다”고 말했다.
자누비아는 미국식품의약국, 유럽의약품청, 식품의약품안전처로부터 최초로 승인 받은 DPP-4 억제제다. DPP-4 억제제 중 최초로 2008년 국내에 출시됐으며, 현재 국내에서 시판 중인 DPP-4 억제제 중 단독요법부터 인슐린 병용 요법에 이르기까지 폭 넓은 범위의 적응증을 보유하고 있다. 또한 DPP-4 억제제 시타글립틴 단일제 자누비아, 시타글립틴과 메트포르민 복합제 자누메트, 그리고 시타글립틴과 서방형 메트포르민 복합제인 자누메트엑스알로 DPP-4 억제제 브랜드 중 가장 많은 제형을 제공하고 있다.
References
i. JANUVIA®USprescribinginformation.
ii. JANUVIA prescribing information, MSD Korea.
iii. Data on MSD. (DPP-4 억제제국내승인현황)
iv. JANUMET®USprescribinginformation.
v. Kim SS, Kim IJ, Lee KJ et al. Efficacy and Safety of Sitagliptin/Metformin Fixed-Dose Combination Compared with Glimepiride in Patients with Type 2 Diabetes: A Multicenter, Randomized, Double-Blind Study. Journal of Diabetes. 2016;27(5).
vi. Data on MSD. (IMS 2016년연간원외처방액자료, 자누비아패밀리기준)
vii. Green JB et al. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2015 Jul 16;373(3):232-42.
viii. Cornel, et al. Effect of Sitagliptin on Kidney Function and Respective Cardiovascular Outcomes in Type 2 Diabetes: Outcomes From TECOS. Diabetes Care.2016 Oct; dc161415.
xi. Linagliptin prescribing information.
xii. Vildagliptin prescribing information.
xiii. Saxagliptin prescribing information.
xiv. Gemigliptin prescribing information.
xv. Alogliptin prescribing information.
xvi. Anagliptin prescribing information.
xvii. Teneligliptin prescribing information.
xviii. Evogliptin prescribing information.
xix, JANUMET prescribing information, MSD Korea.
xx, JANUMETXR prescribing information, MSD Korea.
xxi. Data on MSD. (DPP-4 억제제제형승인현황)
a IMS 2008- 2016년 연간원외처방액자료, 자누비아패밀리기준
b. 이 연구는 무작위배정·다기관진행·이중맹검방식으로 전국 21개 기관의 제 2형 당뇨병환자 292명을 시타글립틴+메트포르민 고정용량복합제 투여군(n=147)과 글리메피리드 투여군(n=145)으로 임의배정해 진행됐다. 연구의 1차평가변수는 약물투여 30주 시점의 기저치(Baseline) 대비 당화혈색소(HbA1c) 수치의 변화였으며, 30주후 당화혈색소(HbA1c) 수치가 7.0%(53mmol/mol) 미만으로 감소한 환자의 비율 및 기저치대비 공복혈당변화량이 2차 평가변수로 설정됐다. 또한 안전성관련으로는 기저치로부터의 체중증가와 부작용발생빈도를 측정했다. 시타글립틴+메트포르민 고정용량복합제 투여군은 50/500mg의 용량을 식사와 함께 일 2회 복용했으며, 4주동안은 1회 복용량을 50/1,000mg까지 증량할 수 있도록 했으며, 이후 내약성문제 발생시 8주까지 감량하여 복용하도록 했다. 또한 글리메피리드 투여군은 식전 1mg씩일 1회 복용으로 시작해, 복용량 조절필요시 의료진의 판단 및 ADA(American Diabetes Association) 가이드라인에 따라 8주동안 하루 6mg까지 증량투여했으며, 투여 8주이후부터는 투여량 변동없이 투약을 유지했다.v
c. TECOS 연구는 심혈관계질환을 확진받은 제 2형 당뇨병환자들을 대상으로, 제 2형 당뇨병 표준치료에 위약추가투여대비 시타글립틴투여시의 장기적인 심혈관계안전성을 평가하기위해 무작위배정, 이중맹검, 위약대조형태로 설계된연구다. 참여환자중 14,671 명이 처리의향분석(Intention-to-treat(ITT) 분석) 대상군에 포함되었으며, 7,332 명은 시타글립틴투여군에, 그리고 7,339명은 위약투여군으로 분류해 각각 표준치료요법에 시타글립틴 1일 100mg(사구체여과율 30 mL/min/1.73 m2 이상, 50 mL/min/1.73 m2 미만인 경우 1일 50mg 투여)과 위약을 각각 투여했다. TECOS 연구에 등록된 대상은 50세이상으로 제 2형당뇨병과 함께 관상동맥, 뇌혈관, 말초동맥 등 심혈관계질환을 확진받은 환자들로 이중 당화혈색소수치(HbA1c)의 기저값이 6.5 ~ 8.0 %에 해당되며, 메트포르민, 피오글리타존 또는 설폰요소제 단독요법 또는 2제 병용요법, 인슐린제재 단일요법 또는 메트포르민과의 병용요법이 최소 3개월이상 안정적인 상태를 유지한 환자들을 대상으로 진행됐다. 환자추적조사기간의 중앙값은 3년이었으며, 최대추적조사기간은 5.7년이었다. 1차 복합평가변수는 심혈관계관련사망, 비치명적인심근경색, 비치명적인뇌졸중, 불안정협심증으로 인한 입원중 첫번째 발생사건으로 정의됐으며, 1차 복합평가변수에 포함된 개별사건, 치명적 및 비치명적 심근경색, 치명적 및비 치명적 뇌졸중, 모든 원인으로 인한 사망, 심부전으로 인한 입원발생이 2차평가변수에 포함됐다. 비열등성입증을 위한 1차 가설은 시타글립틴투여와 위약투여의 계획서순응분석(PP 분석, Per Protocol analysis) 대상자군에서의 심혈관계안전성복합평가변수의 위험발생비율의 상한선이 95% 신뢰구간에서 1.3을 넘지않고, 처리의향분석(Intention-to-treat(ITT) 분석) 대상자집단내에서도 이를 뒷받침하는 결과가 도출되는지의 여부를 기준으로 하였다.vii
d. 해당연구는 TECOS 연구결과에 대한 하위분석으로 TEOCS 연구참여환자들을 대상으로 추정사구체여과율(estimated glomerular filtration rate, eGFR) 기저값에 따른 만성신장질환과 심혈관계사건발생을 평가하기 위해 진행됐다. 환자들을 추정사구체여과율의 기저값을 기준으로 1단계(≥90mL/min/1.73m2), 2단계(60-89mL/min/1.73m2), 3a단계(45-59mL/min/1.73m2), 3b단계(30-44mL/min/1.73m2) 네그룹, 소변알부민크레아티닌비율(Urine Albumin-to-Creatinine Ratio) 기저값을 기준으로 정상단백뇨(<30mg/g), 미세단백뇨(30-300mg/g), 알부민뇨(>300mg/g) 세그룹으로 구분, 그룹별로 추적관찰기간 3년동안의 만성신장질환 및 심혈관계사건 발생위험이 평가됐다. 추정사구체여과율 또는 소변알부민크레아티닌비율 그룹분류와 심혈관계사건 발생과의 상관관계는 콕스회귀분석(cox proportional hazard regression)을 통해 평가됐다. TECOS 연구프로토콜 및 통계분석계획에 따라 추정사구체여과율과 소변알부민크레아티닌비율 기저값으로부터의 변화가 신기능관련 연구데이터에 포함됐으며, 반복측정분산분석(repeated measures ANOVA)을 통해 자누비아와 위약투여그룹간의 4년동안의 추정사구체여과율과 소변알부민크레아티닌비율 차이를 평가했다.viii