전이성 방광암 약물치료, 30년만에 새로운 역사[1]
로슈 면역항암제 티쎈트릭Ⓡ, 전이성 방광암 환자의 장기 생존 가능성 확인[3]
PD-L1 발현율 관계 없이 반응 보여, 방광암 환자들에게 티쎈트릭Ⓡ의 치료 옵션 제공 기대3
㈜한국로슈(대표이사:매트 사우스, Matt Sause)는 자사의 항 PD-L1면역항암제 티쎈트릭Ⓡ(TecentriqⓇ, 성분명:아테졸리주맙)을 국소 진행성 또는 전이성 요로상피암 환자를 위한 2차 치료제로 지난 4월 24일 국내 출시했다고 밝혔다.[4]
티쎈트릭Ⓡ은 백금 기반 화학요법제 치료 도중 또는 이후에 질병이 진행했거나 백금 기반의 수술 전 또는 수술 후 보조요법 치료 12개월 이내에 질병이 진행한 국소 진행성 또는 전이성 요로상피암 환자에게 단독 투여한다. 1,200mg을 3주 간격으로 투여하는데, 첫 용량은 60분 동안 점적 정맥 주입하며, 첫 주입에 내약성을 보인 경우 모든 주입은 30분 동안 투여할 수 있다.4
㈜한국로슈 의학부 김수정 상무는 “전이성 방광암은 5년 생존율이 5%에 불과한 질환이며[5], 재발 이후 표준 치료법이 항암화학요법을 제외하고는 매우 제한적이다[6]”며 “30년만의 방광암 신약인 티쎈트릭Ⓡ의 국내 출시를 통해 방광암 재발 환자들에게 혁신적인 치료 옵션을 제공하게 돼 기쁘다1”고 밝혔다.
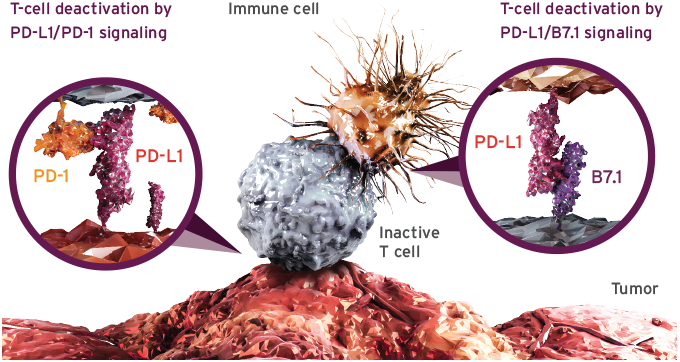
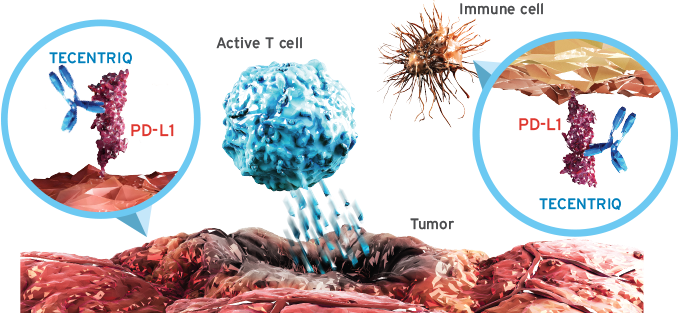
티쎈트릭Ⓡ은 방광암 최초로 미국식품의약국(FDA, Food and Drug Administratin)의 허가를 받은 항 PD-L1 면역항암제로2, 암세포와 면역세포의 PD-L1과 결합해 PD-1수용체와의 결합을 차단함으로써 T-세포의 항암 작용을 회복시키는 단클론 항체다2. 면역항암제는 암세포를 직접 공격하던 기존 항암요법과 달리 인체의 면역기능을 이용한다는 점에서 새로운 패러다임의 치료제로 평가받고 있다.2
아울러, IMvigor 210 Cohort 2(n=310) 전향적 2상 임상 연구에서 티쎈트릭Ⓡ을 투여 받은 환자의 객관적반응률(ORR, Objective Response Rate, per IRF RECIST v1.1)은 16%(95% CI, 12 to 20), 완전반응률(CR, Complete Response)은 6%(95% CI, 4 to 9)로 나타났다.3 PD-L1 발현율이 높은 환자군에서 객관적반응률(ORR)도 더 높게 나타났으나, 모든 환자군에서 유의한 반응이 확인됐다.[IC0: 9%(95% CI, 4 to 16), IC1: 11%(95% CI, 6 to 19), IC1/2/3: 19%(95% CI, 14 to 25), IC2/3: 28%(95% CI, 19 to 38)]3
티쎈트릭Ⓡ을 투여받은 후 반응을 보인 환자 중 65% (32/49, per IRF RECIST v 1.1)의 환자에서 반응이 21개월(중간값) 추적 기간 동안 지속되고 있다.3 전체생존기간(OS, Overall Survival)의 중앙값은 7.9개월(95% CI, 6.7 to 9.3), 12개월 생존율(12-month OS rate)은 37%(95% CI, 31 to 42)로 장기 생존의 가능성이 확인됐다.3 3등급 이상의 이상반응 발생률은 2% 이하로 관리 가능한 수준이었다.3
㈜한국로슈 매트 사우스 대표는 “항암제 분야의 글로벌 리더 로슈의 면역항암제 티쎈트릭Ⓡ은 국내 전이성 방광암 환자들에게 장기 생존 등 보다 개선된 치료 가능성을 제공할 것3”이라며 “PD-L1 발현율에 관계 없이 모든 환자들에게 유의미한 임상 반응이 확인된 만큼 더 많은 국내 전이성 방광암 환자들에게 희망이 될 수 있도록 최선의 노력을 다하겠다3”고 강조했다.
한편 티쎈트릭Ⓡ은 2017년 1월 12일 전이성 방광암 치료제로 식품의약품안전처 시판허가를 받았다.4
References
[1] Jonathan E Rosenberg, et al. Lancet 2016; 387: 1909-20
[2] FDA News Release, ‘FDA approves new, targeted treatment for bladder cancer’, May 18, 2016
[3] Yohann Loriot, et al. ESMO 2016, Oct 7-11, 2016 Copenhagen, Denmark (Poster #783P)
[5] Sun Jin Sym, The Korean Journal of Medicine 2015;89:515-521
[6] NCCN GuidelinesⓇ Bladder Cancer, Ver 2. 2016