국내 허가로 전이성 방광암 환자에게 치료 희망 전해[2]
로슈 면역항암제 ‘티쎈트릭’ 식품의약품안전처 허가 획득2
방광암 최초 면역항암제, 전이성 방광암 분야의 30년만 신약 기대감 높아1,[3]
㈜한국로슈(대표이사:매트 사우스, Matt Sause)는 방광암 최초 항 PD-L1 면역항암제 티쎈트릭(성분명 : 아테졸리주맙)이 식품의약품안전처(이하 식약처)로부터 백금 기반의 치료 도중 또는 이후에 진행된 국소 진행성 또는 전이성 요로상피암(방광암의 일종) 환자 대상 2차 치료제로 1월 12일 국내 품목 허가를 획득했다고 밝혔다.1,2
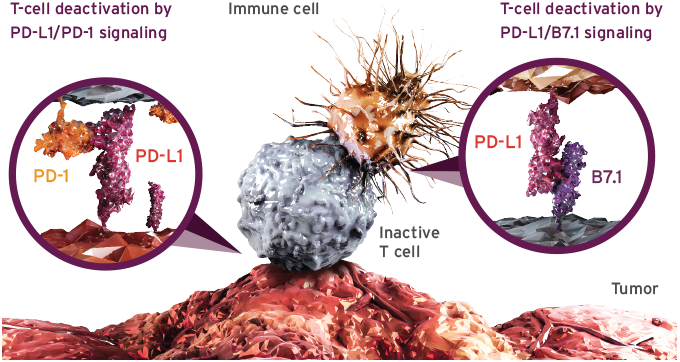
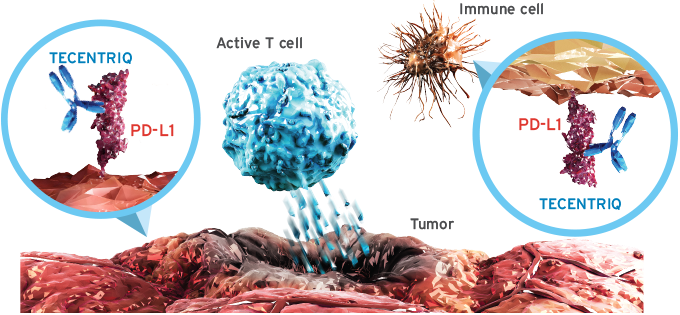
방광암 최초의 항 PD-L1 면역항암제 티쎈트릭은 면역세포 또는 암세포의 PD-1/PD-L1 경로를 표적으로 하여 T 세포가 종양세포들을 효과적으로 발견하고 공격할 수 있도록 돕는다.1 티쎈트릭은 방광암 최초 면역항암제로 치료 옵션이 제한적이던 전이성 방광암 영역에서 임상적 유용성과 안전성을 확인한 30년만의 신약이다.1,3 임상 연구 결과, 티쎈트릭은 PD-L1 발현율과 관계 없이 반응이 나타났으며, 전체생존기간이 12개월 이상인 환자의 비율이 37%로 장기 생존이라는 임상적 유용성을 보였다.[4]
티쎈트릭은 국소 진행성 또는 전이성 요로상피암 환자들 가운데 1)백금 기반 화학요법 치료 중 또는 치료 후 질병 진행이 있는 환자 또는 2) 수술 전 선행 또는 수술 후 보조요법으로 백금 기반 화학요법 후 12개월 이내에 질병 진행이 있는 환자에게 1,200mg을 3주 간격으로 투여한다.2
3대 비뇨기암에 속하는 방광암 환자는[5] 지난 2013년 기준으로 3,762건 발생했으며, 주로 남성(3,025명)에서 발생해 남성암 발생건수 중 7위를 차지하고 있다. [6] 방광암 환자의 대부분은 소변과 직접 접촉하는 요로상피세포에서 유래한 요로상피암이다6. 특히 전체 방광암 환자 중 70대가 35.3%로 가장 많았고, 60대가 24.6%, 80대 이상이 18.0%의 순으로 방광암의 경우 주로 고령의 환자에게서 발병하는 특징이 있다. 6
전이성 방광암은 항암치료를 시행하는데 타 암종과 달리 백금 기반의 화학치료(시스플라틴, 젬시타빈 등) 외에는 치료 옵션이 제한적이었다.[7] 특히, 백금기반 화학요법제로 치료받던 환자들은 이후 질병이 진행되는 경우, 고령의 환자들이 대부분인 질병의 특성 및 2차 치료에서 정해진 표준 요법이 없어 다른 암종에 비해 매우 제한적인 치료 옵션을 가지고 있었다.[8] 따라서, 이번 티쎈트릭의 허가는 이러한 환자들에게 30년 만에 새로운 치료 옵션을 제공하게 되었다.1,3
티쎈트릭의 효과와 안전성은 IMVigor 210 Cohort 2 임상 연구 결과를 통해 확인된 바 있다. 4 전이성 방광암 환자 310명을 대상으로 진행한 전향적 2상 임상 연구 결과, PD-L1 발현율에 관계 없이 투여 반응이 관찰됐다. 4 티쎈트릭의 추적기간 중간값은 21 개월로 2차 종료점 중 하나인 반응지속기간 (Duration of Response) 의 중간값은 현재 도달하지 않았으며, 65% (32/49, per IRF RECIST v 1.1) 의 환자에서 반응이 지속중이다.4 1차 종료점인 객관적반응률(ORR, Objective Response Rate)은 16%(95% CI, 12 to 20), 완전반응률(CR, Complete Response)은 6%(95% CI, 4 to 9)로 나타났다. 4 2차 종료점은 전체생존기간(OS, Overall Survival)으로 중앙값은 7.9개월이었으며(95% CI, 6.7 to 9.3), 전체생존기간(OS)이 12개월 이상인 환자의 비율은 37%(95% CI, 31 to 42)로 나타나 장기 생존의 가능성도 확인됐다.4
티쎈트릭 투여와 관련 있는 이상반응(모든 등급)으로 피로, 오심, 가려움증, 식욕감소, 발열, 설사, 면역 매개성 부작용 (폐, 간, 신장, 내분비계 등에서 발생) 등의 이상반응이 관찰됐으나, 3등급 이상의 이상반응 발생률은 2% 이하로 관리가능한 수준이었다.4
㈜한국로슈 매트 사우스 대표는 “방광암 최초의 항 PD-L1 면역항암제 티쎈트릭1은 30년간 치료 옵션이 제한적이었던 전이성 방광암 신약으로3, 치료 대안이 없었던 환자들에게 강력한 치료 효과를 보였으며 생존기간을 연장했다는 점에서 의미가 크다4”며, “로슈는 50여년간 항암제 발전을 선도해온 글로벌 리더로서 앞으로도 지속적인 파이프라인 개발과 임상연구를 통해 한국 환자들에게 혁신적인 치료제를 제공하기 위해 최선을 다하고 있다”고 강조했다.
티쎈트릭에 대하여
티쎈트릭은 단클론항체로서 면역세포 또는 암세포의 PD-1/PD-L1 경로를 표적으로하는 방광암 최초의 항 PD-L1 면역항암제다. 1암세포를 공격하던 기존 항암요법과 달리 인체의 면역기능을 이용하여 암세포를 공격하도록 하는 새로운 패러다임의 치료제다. 1 또한 면역세포의 PD-1을 표적으로 하는 기존 면역항암제와 달리 암세포의 PD-L1을 표적으로 한다는 점에서 차이가 있다.1
티쎈트릭은 전향적 2상임상연구인 IMVigor210 Cohort 2를 통해 전이성방광암에서 유효성 및 안전성을 확인했으며, 특히 1년 이상 생존한 환자의 비율이 37%에 달한 것으로 나타나 장기생존(long term survival) 측면에서 이점이 있는 것으로 나타났다.4 또한 티쎈트릭은 진행성비소세포폐암 환자를 대상으로한 OAK 3상임상연구에서도 세탁셀 대비 전체생존기간(OS)을 유의하게 개선했다(티쎈트릭 13.8개월 vs. 도세탁셀 9.6개월).7
두 임상연구를 근거로 티쎈트릭은 미국 식품의약국(FDA)로부터 혁신적치료제로 지정(Breakthrough Therapy Designation)됐으며, 우선심사 및 신속승인을 거쳐 지난 2016년 5월 전이성방광암, 10월 진행성비소세포폐암 치료제로 FDA 승인을 획득했다.1,4, (진행성비소세포폐암은 국내 식품의약품안전처승인을 받지 않은 적응증이다.)
IMVigor210 Cohort 2 임상연구에 대하여4
IMVigor210는 국소진행성·전이성요로상피암 환자 대상으로 두집단(cohort)로 나누어 진행한 다기관, 단일군, 제 2상 전향적임상연구다. 티쎈트릭은 IMVigor210 Cohort 2(N=310)를 통해 백금기반 화학요법치료 도중 또는 이후에 질병이 진행된 국소진행성 또는 전이성 요로상피암의 2차치료제로서 유효성 및 안전성을 확인하였다. 연구에 참여한 환자들은 티쎈트릭 1,200mg을 3주 간격으로 정맥투여받았다. 1차 종료점(co-primary endpoints)는 객관적반응률(ORR, Objective Response Rate,ORR per RECIST v1.1 according to a central IRF, Immune-modified RECIST ORR), 2차 종료점(secondary endopoints)는 전체생존기간(OS, Overall Survival), 반응지속기간(DOR, Duration of Response), 무진행생존기간(PFS, Progression Free Survival), 안전성이었다. 환자들은 PD-L1 발현율에 따라 IC0~IC3으로 분류됐으며, 각 단계에서 고르게 분포돼 있었다(IC0 33%, IC1 35%, IC2/3 32%,VENTANA SP142 IHC assay).
지난 2016년 10월 유럽종양학회(ESMO, European Society for Medical Oncology)에서 추가로 공개된 임상결과에 따르면 티쎈트릭을 투여한 전이성방광암 환자들은PD-L1 발현율에 관계없이 반응이 관찰됐다. 주요 분석결과는 아래와 같다.
- 전체환자군에서 객관적반응률(ORR, Objective Response Rate, per IRF RECIST v1.1)은 16%(95% CI, 12 to 20), 완전반응률(CR, Complete Response)은 6%(95% CI, 4 to 9)로나타났다. PD-L1 발현율이 높을수록 티쎈트릭의 반응이 높게 관찰되었다.
- 전체생존기간(OS, Overall Survival)의 중앙값은 전체환자기준7.9개월이었으며(95% CI, 6.7 to 9.3), 전체생존기간(OS)이 12개월 이상인 환자의 비율은 37%(95% CI, 31 to 42)로 나타나 장기생존의 가능성을 확인하였다.
- 본 임상연구의 추적기간의 중간값은 21개월이다. 반응지속기간(DOR)의 중앙값은 아직 도달하지 않았다.
- 현재 티쎈트릭에 반응한 환자의 65%에서 반응이 지속되고 있다.
- 티쎈트릭 투여와 관련있는 이상반응(모든 등급)으로피로, 오심, 가려움증, 식욕감소, 발열, 설사, 면역매개성부작용(폐, 간, 신장, 내분비계등에서발생) 등의 이상반응이 관찰됐으나, 3등급 이상의 이상반응발생률은 2% 이하로 관리가능한 수준이었다.
FDA>Drugs>Drug Approvals and Databases>Approval Drugs>Atezolizumab(TECENTRIQ)
References
[1] FDA News Release, ‘FDA approves new, targeted treatment for bladder cancer’, May 18, 2016
[3] Jonathan E Rosenberg, et al. Lancet 2016; 387: 1909-20
[4] Yohann Loriot, et al. ESMO 2016, Oct 7-11, 2016 Copenhagen, Denmark (Poster #783P)
[5] 보건복지부 보도자료, ‘전국민 암발생률 3년 연속 감소’, 2016.12.19
[6] 국가암정보센터>내가알고싶은암>암의종류>방광암
[7] 건강보험심사평가원 공고 제2016-343호, 암환자에게 처방·투여하는 약제에 대한 요양급여의 적용기준 및 방법에 관한 세부사항, Released on 2016-12-30
[8] NCCN Guidelines, Bladder Cancer, Version 2. 201