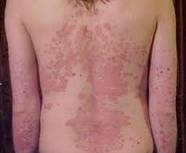
새로운 연구 결과 발표, 치료 중단 환자 코센틱스®로 다시 치료 진행 후 16주 만에
환자의 94%가 PASI 75 도달, 79%의 환자는 PASI 90 도달1
장기간 깨끗한 혹은 거의 깨끗한 피부(PASI 90~100) 유지해
우스테키누맙 또는 에타너셉트 대비 월등하고 지속적인 치료 효과 입증 2,3
현재까지 전세계 4만 7천명 이상의 건선 환자가 치료받은 코센틱스4,
건선, 건선성 관절염, 강직성 척추염 치료제로 승인 받은 유일한§ IL-17A 억제제5,6,7,8,9,10,11
노바티스는 치료 중단으로 재발된 중등도 및 중증의 건선 환자들을 코센틱스®(성분명: 세쿠키누맙)로 치료한 결과, 환자들이 빠르게 깨끗한 혹은 거의 깨끗한 피부(건선 중증도 지수, PASI 90~100)로 회복한 것으로 나타났다고 밝혔다1. 더불어 재 치료 기간 중 세쿠키누맙에 대한 항체가 형성되지 않은 것으로 나타났다1. 이번 연구 결과는 미국 플로리다 주 올랜도에서 열린 2017 미국피부과학회(AAD) 연례 학술대회에서 발표됐다.
기존 데이터에 따르면 건선은 불규칙적인 치료에 비해 규칙적인 간격으로 치료하는 것이 지속적 치료 효과가 우월하다고 입증된바 있다. 그럼에도 불구하고 건선 치료를 중단하는 환자들이 종종 있을 수 있다 12. 이번 새로운 분석 결과에 의하면, 건선 환자가 치료 중단으로 증상이 재발해 코센틱스로 재 치료한 경우, 대부분의 환자가 치료 16주 만에 기존의 높은 치료 효과에 다시 도달할 수 있는 것으로 나타났다 1. 많은 생물학적 건선 치료제는 시간이 지나면 면역원성으로 인해 장기적인 치료 효능에 문제가 생긴다. 코센틱스는 면역원성이 거의 없는 것으로 입증된 바 있다1,13. 코센틱스는 완전 인간 항체로 인터루킨-17A(IL-17A) 사이토카인을 선택적으로 억제한다14.
노바티스 의약품 개발 부문 총 책임자 바스 나라시만(Vas Narasimhan)은 “환자들이 지속적으로 치료를 받아야 최선의 결과를 얻을 수 있다는 점은 분명하다. 그러나 이번 분석 결과는 치료가 어떤 이유로 중단되었더라도 코센틱스를 통해 깨끗한 피부를 다시 빠르게 회복할 수 있고, 환자와 의사 모두가 안심할 수 있다는 점에서 의미가 있다”고 말했다.
이번 분석은 코센틱스(300mg) 치료 1년 차에 PASI 75 반응에 도달한 이후 치료를 중단하고 같은 용량의 위약을 투여 받은 후 증상이 재발한 환자 총 136명을 대상으로 했다. 그 결과 코센틱스 재 치료 16주 후 환자의 94%가 다시 PASI 75에 도달했으며, 기존 PASI 90에 도달했던 환자 117명 중 79%가 다시 PASI 90에 도달, 기존 PASI 100에 도달했던 환자 67명 중 67%가 다시 PASI 100에 도달했다1. 안전성 프로파일은 기존 연구2, ŋ에서와 같이 긍정적이고 일관되게 나타났다. 또한 이번 분석에서 세쿠키누맙에 대한 항체가 형성된 환자가 관찰되지 않았다1. 기존 연구에서도 코센틱스 치료 환자의 76%는 52주차에 PASI 90에 도달해 거의 깨끗한 피부를 장기간 유지하는 것으로 나타났다2.
코센틱스는 건선, 건선성 관절염, 강직성 척추염 치료에 승인된 유일한§ IL-17A 억제제 5,6,7,8,9,10,11로, 시판 후 전세계 4만 7천명 이상의 건선 환자가 코센틱스로 치료4,*를 받았다. 국내에서는 2015년 9월 광선요법 및 전신요법(약품이 전신에 흡수되어 전신으로 퍼지는 치료법)을 필요로 하는 중등도 및 중증의 성인 판상 건선 치료제로 식품의약품안전처의 승인15,16을 받았으며, 2016년 2월 강직성 척추염과 건선성 관절염에 대해 추가로 적응증을 승인17 받았다.
* 2016년 11월 기준
§ 국내와 FDA 승인 기준
ŋ 세쿠키누맙과 우스테키누맙을 직접 비교한 무작위, 이중맹검 임상 3상 시험인 CLEAR 연구의 52주차 결과
참고자료
코센틱스® 및 인터루킨-17A (IL-17A)
2015년 1월 미국, 유럽 등에 출시된 코센틱스는 IL-17A 사이토카인을 선택적으로 억제하는 표적 치료제다18. 코센틱스는 4년 동안 입증된 지속성 및 안정성 프로파일을 제공하며, 이를 통해 환자들이 깨끗한 혹은 거의 깨끗한 피부를 장기간 유지할 수 있는 효과를 보였다 19.
코센틱스는 한국을 비롯해 유럽연합, 일본, 스위스, 호주, 미국, 캐나다 등 71개 국가에서 중등도 및 중증 판상 건선 치료제로 승인을 받았다18. 코센틱스는 유럽에서 중등도 및 중증 판상 건선 성인 환자에 대해 1차 전신 치료제로 승인을 받았다 20. 코센틱스는 미국에서 전신치료 또는 광선치료 대상 성인 환자에 대해 중등도 및 중증 판상 건선 치료제로 승인됐다21.
또한 코센틱스는 한국을 비롯해 유럽연합과 미국 등 63개 국가에서 강직성 척추염(AS)과 건선성 관절염(PsA) 치료제로 승인된 최초의 IL-17A 억제제다18. 일본에서는 건선성 관절염과 농포성 건선 치료제로도 승인을 받았다18.
코센틱스® 재 치료 연구에 대하여1
코센틱스와 위약을 비교한 무대조군 ERASURE(Efficacy of Response and Safety of Two Fixed Secukinumab Regimens in Psoriasis) 연구의 연장 연구와 코센틱스와 위약 및 에타너셉트를 비교한 FIXTURE(Full Year Investigative Examination of Secukinumab vs. Etanercept Using Two Dosing Regimens to Determine Efficacy in Psoriasis) 연구다 1. 핵심 연구(52주) 종료점에서 PASI 75 반응에 도달한 환자 181명은 코센틱스 150mg, 코센틱스 300mg, 위약군으로 무작위 배정돼, 104주까지 4주마다 치료를 받았다1. 재발을 보인 위약군 환자들은 코센틱스로 재치료를 받았다.
생물학적 제제와 면역원성에 대하여13
건선 치료에 생물학적 제제를 사용할 경우 약물에 의한 항체(ADA)가 생겨 치료 효능에 영향을 줄 수 있다. 최대 52주까지 코센틱스로 치료받은 6가지 제3상 임상시험의 중등도 이상 판상 건선 환자들 가운데 총 2,842명의 혈액 샘플로 0, 12, 24, 52주차와 추가적으로 60주차에 면역원성에 대해 평가한 연구 결과에 따르면, 코센틱스는 환자 2,842명 가운데 11명 (0.4%) 만이 ADA 반응을 보여 면역원성이 거의 없는 것으로 나타났다13.
건선에 대하여
건선은 흔한 비전염성 면역매개 질환으로, 전세계에서 약 1억 2,500만명 이상이 건선을 앓고 있다22. 건선 중 가장 흔한 형태는 판상 건선으로, 죽은 피부 세포가 쌓이면서 붉게 부어 오른 반점과 은빛의 하얀 각질이 특징이다.
건선은 미관에 좋지 않을 뿐 아니라 장기간 지속되는 만성 질환으로, 환자는 간혹 일상의 사소한 것에도 영향을 받아 고통을 호소한다. 건선 환자의 최대 30%는 건선성 관절염을 동반하거나 건선성 관절염으로 발전한다23. 건선성 관절염은 관절에 영향을 주어 통증, 경직, 비가역적 관절 손상 등의 증상이 나타난다23,24. 또한 건선은 당뇨병, 심장질환, 우울증과 같은 다른 중증 질환과도 연관성이 있다23.
노바티스에 대하여
스위스 바젤에 본사를 두고 있는 노바티스그룹(www.novartis.com)은 혁신적인 전문의약품, 안과사업, 제네릭사업부문에서 우수한 제품 포트폴리오를 구축하여 사회와 환자들에게 필요한 의료적 니즈에 맞는 헬스케어 토탈 솔루션을 제공한다. 2015년 노바티스 그룹은 순매출 494억 달러(55조2천억 원)를 기록했으며, 그룹 전체의 R&D 투자는 약 89억 달러(10조7천억 원)를 투자했다. 현재 세계 180 개 국에서 약 11만 여 명의 노바티스 직원들이 일하고 있다.
References
1. Blauvelt A et al. Secukinumab Retreatment Shows Rapid Recapture of Treatment Response: An Analysis of a Phase 3 Extension Trial in Psoriasis. Presented as a poster at the American Academy of Dermatology 2017. 5th March 2017.
2. Blauvelt A et al. Secukinumab is superior to ustekinumab in clearing skin of subjects with moderate-to-severe plaque psoriasis up to 1 year: Results from the CLEAR study. J Am Acad Dermatol. September 2016. Available from http://dx.doi.org/10.1016/j.jaad.2016.08.008 Epub ahead of print. 3. Langley RG et al. Secukinumab in plaque psoriasis – results of two phase three trials. N Engl J Med. 2014;371(4):326–338
4. Novartis data on file. Accessed Mar. 14, 2017
5. FDA. Cosentyx PI 2016
7. FDA. brodalumab PI 2017
8. FDA. ixekizumab PI 2016
9. 온라인의약도서관. 판상 건선. Accessed Mar. 15, 2017
10. 온라인의약도서관. 건선 관절염. Accessed Mar. 15, 2017
11. 온라인의약도서관. 강직성 척추염. Accessed Mar. 15, 2017
12. Mrowietz U et al. Secukinumab retreatment-as-needed versusfixed-interval maintenance regimen for moderate to severe plaque psoriasis: A randomized, double-blind, noninferiority trial (SCULPTURE). J Am Acad Dermatol 2015;73:27-36
13. Reich K et al. Secukinumab, a fully human anti‐interleukin‐17A monoclonal antibody, exhibits minimal immunogenicity in patients with moderate‐to‐severe plaque psoriasis. British Journal of Dermatology. 2016
14. Kirkham BW et al. Interleukin-17A: a unique pathway in immune-mediated diseases: psoriasis, psoriatic arthritis and rheumatoid arthritis. Immunology. 2014; 141:133–142.
18. Novartis data on file: PSUR 26 Jun 2016 to 25 Dec 2016
19. Bissonnette R et al. Secukinumab maintains high levels of efficacy through 4 years of treatments: results from an extension to a phase 3 study (SCULPTURE). Presented as a late breaking abstract at the European Academy of Dermatology and Venereology 2016. 1st October 2016
21. Cosentyx (secukinumab) [prescribing information]. East Hanover, NJ: Novartis Pharmaceuticals Corp, 2016.
23. National Psoriasis Foundation. Psoriatic disease: about psoriasis. Available at: www.psoriasis.org/about-psoriasis. Accessed February 2017.
24. Mease PJ, Armstrong AW. Managing patients with psoriatic disease: the diagnosis and pharmacologic treatment of psoriatic arthritis in patients with psoriasis. Drugs. 2014; 74:423–441.