넥사바® 치료 경험이 있는 간세포성암 환자에서 전체 생존기간 유의하게 개선시킨 최초의 전신 치료제
FDA 신속심사 지정 거쳐 최 종 승인 받아
Pivotal 3상 RESORCE 연구로 넥사바® 투여 후 스티바가®, 새로운 간세포성암 치료법 제시
바이엘, 간암 치료 분야의 리더십 강화 계기
바이엘은 자사의 표적치료제인 스티바가® (성분명: 레고라페닙, Regorafenib)가 4월 27일 미국 식품의약국(FDA)로부터 넥사바® (성분명: 소라페닙, Sorafenib) 치료 경험이 있는 간세포성암(HCC) 환자 2차 치료제로 승인 받았다고 밝혔다.
스티바가®는 간세포성암 2차 치료제로서 전체 생존기간을 유의하게 개선한 최초의 치료제다. 바이엘은 이번 FDA 승인을 기점으로 넥사바® 이후 투여할 수 있는 2차 치료제를 구축해 간암 치료 분야의 리더십을 공고히 하게 됐다. 스티바가®는 종양 형성, 종양 혈관 신생, 전이 및 종양 면역과 같은 병리과정과 일반 세포 기능에 관여하는 경구용 멀티 키나제억제제이다. 이번 FDA 승인은 넥사바®로 치료를 받는 중에도 질환이 진행된 간암 환자들을 대상으로 한 다국적, 다기관, 위약대조 3상 임상시험 RESORCE 연구를 근거로 이뤄졌다.
전세계적으로 발병률이 증가하고 있는 간암은 세계에서 6번째로 흔한 암이자 암 사망원인 2위를 차지하는 암이다.
RESORCE 연구의 수석 연구원인 스페인 바르셀로나 대학병원 조디 브뤽스(Jordi Bruix) 교수는 “간세포성암은 치료가 어렵고 지난 10년 동안 새로운 치료법이 없어 의사와 환자들의 선택 폭이 제한적인 상황이었다.”며 “스티바가®가 FDA 로 부터 간세포성암 치료제로 승인 받음으로써 치료 대안이 절실하던 간세포성암 환자들에게 중요한 발자국이 될 것”이라고 말했다.
바이엘의 부사장이자 종양전략사업부 총괄책임자인 로버트 라카제(Robert LaCaze)는 “바이엘이 간세포성암 치료에 중요한 역할을 하게 되어 자랑스럽게 생각한다.”며 “바이엘은 20년전부터 간암 분야에 대한 연구에 착수해 많은 분들의 도움 덕에 좋은 성과를 얻게 되었으며, 특히 RESORCE임상시험에 참여했던 환자와 간병인, 관계자들에게 감사를 전한다” 고 덧붙였다.
스티바가®가 FDA 신속심사(Priority review) 대상으로 최종 승인을 받은 것은 전이성 직장결장암(mCRC), 전이성 또는 절제 불가능한 국소진행성 위장관기질종양에 이어 세번째다. FDA는 간세포성암에 대해 스티바가®를 중증 질환 및 치명적인 질환의 의학적 수요를 충족시키기 위해 개발 및 검토를 촉진하는 프로그램인 신속심사 대상으로 지정(Fast track designation)한 바 있다.
한편, 간세포성암에 대한 스티바가®의 적응증 확대는 EU, 일본 및 중국을 포함한 전세계 여러 국가에서 검토 중이며, EU와 일본의 경우 올해 안에 승인 여부가 결정될 것으로 예상된다.
FDA 승인의 근거가 된 다국적, 다기관 3상 임상시험 RESORCE 연구에서 레고라페닙은 위약군과 비교하여 통계적으로, 임상적으로 유의한 전체생존기간(OS) 개선을 보여(HR 0.63, 95 % CI 0.50-0.79, p <0.0001), 연구기간 동안 사망위험을 37% 감소시켰다. 전체생존기간 중간 값은 레고라페닙 치료군에서 10.6개월, 대조군에서 7.8 개월로 조사됐다. 이 연구의 1차 평가 지수뿐만 아니라 모든 2차 평가 지수도 충족되었다. 무진행 생존기간(PFS) 중앙값은 레고라페닙 치료군은 3.1 개월, 대조군은 1.5개월로 나타났다. (HR 0.46; 95 % CI 0.37-0.56; p <0.0001). 부분 반응률 및 전체 반응률을 포함한 전체 반응률(Overall Response Rate. ORR)은 레고라페닙 치료군과 대조군에서 각각11%와 4%로 나타났다. 2차 평가 지수들의 모든 수치는 mRECIST 기반으로 작성됐다.
이 연구에서 나타난 레고라페닙의 이상 사례들은 기존에 확인된 안전성 프로파일과 일관되게 나타냈다. 3등급 이상의 가장 흔하게 나타난 이상사례(레고라페닙 치료군 Vs. 대조군)는 고혈압(15% Vs. 5%), 손발피부반응(12% Vs. <1%), 무력감/피로(10% Vs. 5%), 통증(9% Vs. 8%), 감염(8% Vs. 6%), 출혈(5% Vs. 8%) 등이었다.
간세포성암 (Hepatocellular Carcinoma, HCC)에 대하여
간세포암종(HCC)는 간암의 가장 흔한 형태로써 전세계적으로 간암의 약 70-80%를 차지한다. 매년 전세계에서 78만명 이상의 간암이 진단 되고 있으며, (EU 52,000명, 서태평양 지역 501,000명, 미국 30,000명) 2012년에는 EU에서 약 48,000명, 서태평양 지역에서 477,000명, 미국에서 24,000명 등 전세계적으로 약 약 74만 6000명이 간암으로 인해 사망했다.
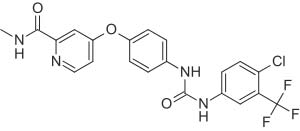
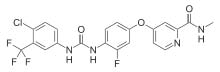
레고라페닙(제품명: 스티바가®) 에 대하여
레고라페닙은 종양 혈관 신생(VEGFR1, -2, -3, TIE2), 종양 형성(KIT, RET, RAF-1, BRAF), 전이(VEGFR3, PDGFR, FGFR) 와 종양 면역(CSF1R )에 관여하여 키아나제 억제하는 경구용 멀티 키나제 억제제다.
레고라페닙은 스타바가라는 제품명으로 미국, EU 그리고 일본을 포함한 90개국 이상에서 전이성 대장암 치료제로 승인되었고, 80개국 이상에서 전이성 위장관기질종양(GIST) 치료제로도 허가되었다. 이번에는 미국에서 이전 소라페닙 치료를 받았던 간세포성암 환자들에게 2차 치료제로 사용할 수 있도록 승인 받았다.
미국에서 스티바가는 이전에 플루오로피리미딘, 옥살리플라틴 및 이리노테칸 기반 화학요법과 항 VEGF 치료제, 항 EGFR 치료제(KRAS 정상형(wild type)의 경우)로 치료받은 적이 있는 전이성 직장결장암 치료제로 승인을 받았다. 또한 이매티닙과 수나티닙으로 치료를 받은적이 있는 전이성 또는 절제불가능한 국소진행성 위장관기질종양 환자들에게도 투여할 수 있다. 6 EU에서 스티바가는 이전에 플루오로피리미딘 기반 화학 요법, 항 VEFG 요법 및 항 EGFR 요법을 받았거나 받을 수 없는 전이성 직장결장암 성인 환자들의 치료제로 활용되고 있으며, 이전에 이매티닙과 수니티닙을 치료 받았으나 질병이 진행되거나 치료를 지속할 수 없는 절제불가, 전이성 위장관기질종양 성인 환자들에도 투여할 수 있다. 7
레고라페닙은 바이엘이 개발한 약품으로, 암젠 자회사 Onyx은 2011년도 바이엘과의 계약을 통해 레고라페닙의 순매출에 대한 로열티를 받게 된다.
바이엘: ‘더 나은 삶을 위한 과학(Science For A Better Life)’
바이엘은 생명 과학 분야에서 헬스케어와 농업 분야에서 핵심 역량을 지닌 글로벌 기업이다. 바이엘의 제품과 서비스는 인류를 이롭게 하고 삶의 질을 향상시킬 뿐만 아니라 혁신, 성장, 높은 수익을 통한 가치 창출을 목표로 하고 있다. 바이엘은 지속 가능한 성장의 원칙에 근거하여 기업 시민으로서의 사회적, 윤리적 책임을 다하고자 노력하고 있다. 회계연도 2016년 기준, 약 115,200명의 임직원이 바이엘에 근무하고 있으며, 매출은 468억 유로, 자본 지출은 26억 유로 그리고 R&D 투자는 47억 유로에 달하며, 이는 바이엘로부터 분사되어 2015년 10월 6일자로 주식 시장에 상장된 첨단 신소재 기업 코베스트로(Covestro)에 대한 투자 비용을 포함한 수치이다. 보다 자세한 정보는 www.bayer.com 에서 확인할 수 있다.