골절 위험성이 높은 골다공증 환자 위한 골다공증 치료 신약, 이베니티™
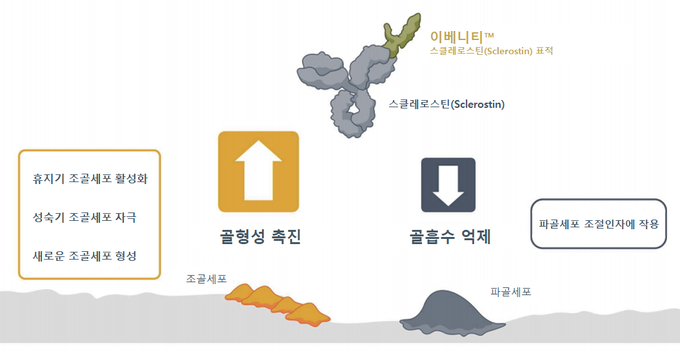
골형성을 저해하는 단백질 스클레로스틴(Sclerostin) 표적 인간화 단클론항체
최초이자 유일한 골형성 촉진∙골흡수 억제 이중효과로 유의미한 골절 위험 감소 효과
암젠코리아(대표: 노상경)는 골형성 촉진과 골흡수 억제의 이중효과를 가진 골형성제제 ‘이베니티™주 프리필드시린지(EVENITY®, 성분명: 로모소주맙)4의 국내 출시를 기념해 12월 4일 서울웨스틴조선호텔에서 기자간담회를 개최했다.
이베니티™는 골형성을 저해하는 단백질인 스클레로스틴(Sclerostin)을 표적으로 하는 인간화 단클론항체 치료제로, 해당 단백질을 억제해 골형성에 관여하는 조골세포의 활동을 활성화시키는 동시에 골흡수를 촉진하는 파골세포의 활동을 감소시킨다.
최초이자 유일하게 골형성 촉진과 골흡수 억제의 이중효과를 가진 이베니티™는 올해 5월 31일 골절 위험이 높은 폐경 후 여성 골다공증 환자의 치료 및 골절 위험이 높은 남성 골다공증 환자의 골밀도 증가를 위한 치료제로 국내 허가를 받았다.
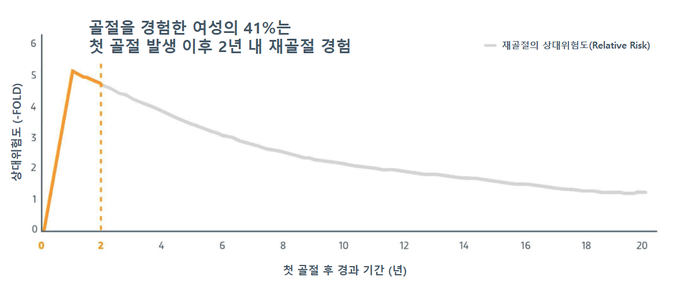
이날 기자간담회 연자로 나선 강동경희대병원 내분비내과 정호연 교수(대한골대사학회 이사장)는 국내 골다공증 재골절 현황에 대한 발표를 통해 “골다공증 골절은 일상생활에 지장을 줄 뿐만 아니라 영구적 장애 및 사망을 불러일으키는데, 일단 한 번 골절이 발생하면 골밀도와 관계없이 척추, 고관절, 손목 등에서 재골절의 위험이 크게 증가한다. 골다공증 골절 환자 4명 중 1명(25%)은 1년 내에 재골절을 경험하고 있으며, 골절 후 1년 내 새로운 골절이 발생할 위험은 5배까지 높아지기 때문에 골다공증 골절 경험 환자의 경우 적절한 약물치료를 통해 골밀도 개선 및 재골절 발생 위험을 낮추는 것이 중요하다”고 강조했다.
또한 정호연 교수는 이어지는 최신 치료지견과 이베니티™ 임상 결과 소개에서 “재골절 위험이 특히 높은 골절 경험 환자는 보다 강력한 치료를 통해 골절을 예방하는 것이 무엇보다 중요하다”며, “골형성 촉진과 골흡수 억제의 이중효과 작용기전을 가진 이베니티™는 골절 위험이 높은 환자들을 대상으로 진행한 여러 임상연구에서 새로운 골절 발생 위험을 효과적으로 낮추는 것으로 나타나, 앞으로 국내 골다공증 환자의 효과적 골절 관리에 큰 도움이 될 것으로 기대하고 있다”고 설명했다.
암젠코리아 노상경 대표는 “이번 이베니티™ 국내 출시를 통해 암젠코리아는 이베니티™에서 프롤리아®로 이어지는 보다 강력하고 포괄적인 골다공증 치료 포트폴리오를 통해 국내 의료진에게 환자의 상태에 따른 다양한 맞춤형 치료옵션을 제공할 수 있게 됐다”며, “앞으로도 암젠코리아는 독보적인 골다공증 치료 리더십을 바탕으로 혁신적인 치료제를 통해 더 많은 국내 골다공증 환자들이 적절히 치료받을 수 있도록 지속적으로 노력하겠다”고 밝혔다.
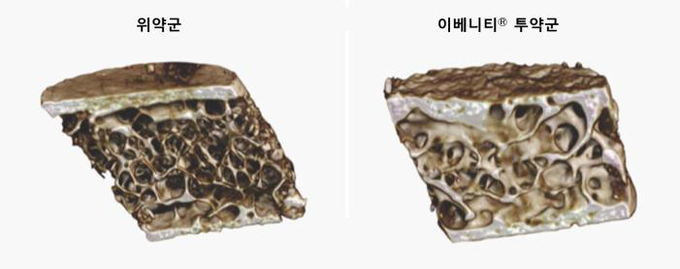
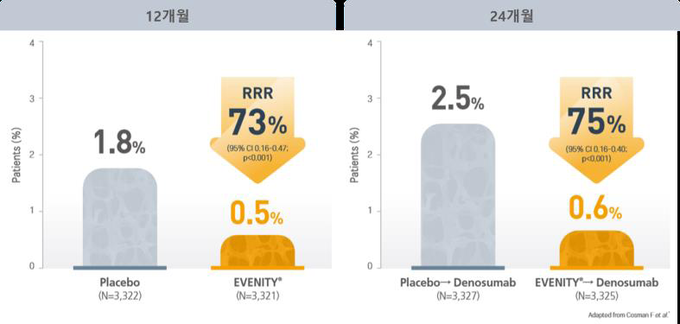
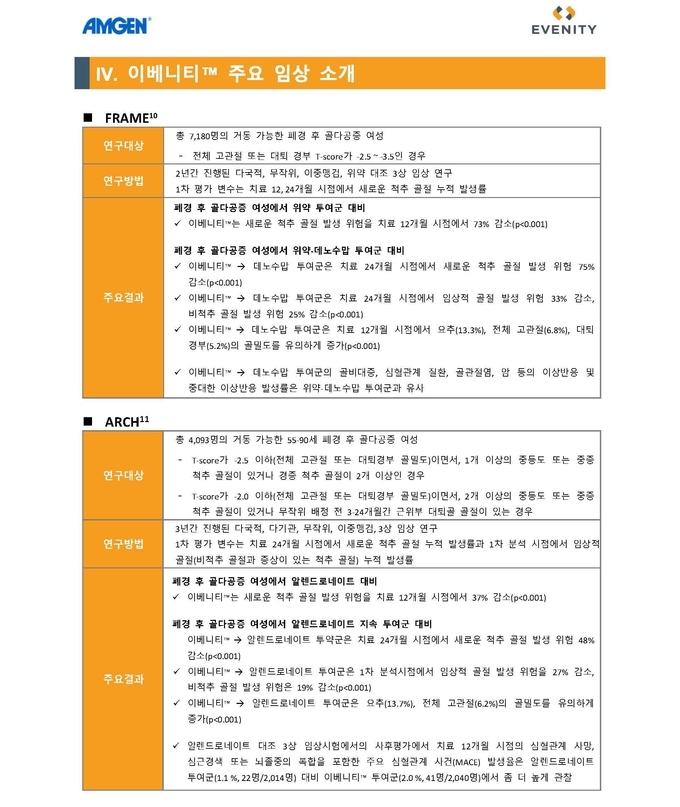
전체 고관절 또는 대퇴골 경부 골밀도 T-score가 -2.5에서 -3.5로 골절 위험이 높은 폐경 후 여성 환자 7,180명을 대상으로 진행한 위약 대조 3상 임상시험인 FRAME 연구에서 치료 12개월 시점에서 이베니티™ 치료군은 위약군 대비 새로운 척추 골절 발생 위험이 73% 감소했다(p<0.001). 이후 두 그룹 모두에게 프롤리아®(성분명: 데노수맙)로 전환하여 12개월 동안 추가 치료를 진행한 결과, 치료 24개월 시점에서 위약-프롤리아® 투여군 대비 이베니티™-프롤리아® 투여군에서는 새로운 척추 골절 발생 위험이 75% 감소한 것으로 나타났다(p<0.001).
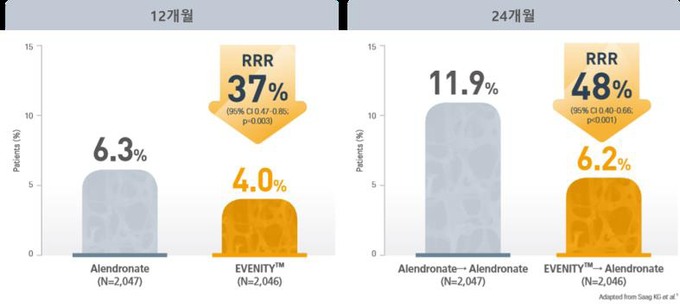
또한 알렌드로네이트(Alendronate) 대조 3상 임상시험인 ARCH 연구에서도 이베니티™의 유의미한 골절 위험 감소 효과가 확인됐다. 골다공증과 취약성 골절이 있는 폐경 후 골다공증 여성 4,093명을 이베니티™와 알렌드로네이트 투여군으로 각각 나누어 1년 동안의 치료를 진행한 결과, 이베니티™ 치료군은 알렌드로네이트 투여군 대비 새로운 척추 골절 발생 위험이 37% 감소했다(p<0.001). 더불어 두 그룹 모두 알렌드로네이트로 전환하여 치료를 진행한 24개월 시점에서는 이베니티™-알렌드로네이트 전환 투여군은 알렌드로네이트 지속 투여군 대비 48%의 척추 골절 발생 위험 감소효과가 나타났다(p<0.001).
비스포스포네이트(Bisphosphonate) 복용 경험이 있는 폐경 후 여성 대상 이베니티™와 테리파라타이드(Teriparatide) 치료 12개월 동안의 전체 고관절 골밀도 변화율을 관찰한 STRUCTURE 연구결과에 따르면 이베니티™ 치료군에서 전체 고관절, 대퇴경부, 요추 골밀도가 테리파라타이드 치료군 대비 유의미하게 증가했다(p<0.0001).
마지막으로 남성 골다공증 환자를 대상으로 한 BRIDGE 임상연구에서는 이베니티™ 투여군의 치료 1년 후 요추 골밀도는 위약군 대비 12.1% 증가돼 유의미한 골밀도 개선 효과를 보였다(p<0.001).
한편, 이베니티™는 한 달에 한 번, 총 210mg 용량을 두 번에 나누어 각각 다른 투여 부위에 105mg씩 연속 2번 피하주사한다. 총 12회 투여하며, 그 이후에는 골흡수억제제를 통한 지속적인 치료가 필요하다. 또한 이베니티™를 투여하는 동안 심근경색 및 뇌졸중의 위험이 증가할 수 있어 지난 1년 이내에 해당 질환을 경험한 환자에게는 투여가 제한된다.
이베니티TM(Evenity®)에 대하여4,5,6,10
이베니티TM는 골형성을 저해하는 단백질인 스클레로스틴(Sclerostin)을 표적해 골형성 증가와 골흡수 억제 이중효과를 나타내는 인간화단클론항체다. 이베니티TM는 14,000명 이상의 환자대상 19개 임상연구를 통해 개발되었다.
대표적으로 폐경후 골다공증 여성환자 대상 광범위한 글로벌 3상 임상연구 FRAME과 ARCH를 통해 우수한 골절예방 및 골밀도개선 효과를 입증했으며, BRIDGE 임상을 통해서 남성골다공증 환자에서도 효과적인 골밀도개선 효과를 나타냈다.
FRAME 임상연구에 대하여6
이베니티TM는 전고관절 또는 대퇴골경부 골밀도 T-score가 –2.5에서 –3.5인 폐경후 여성 골다공증 환자 7,180명을 대상으로 진행된 3상 임상연구(FRAME)에서 위약대비 유의한 골절예방효과를 입증했다. 해당 연구에 참여한 환자들은 이베니티투여군과 위약투여군으로 나뉘어 먼저 12개월간 치료받았고, 그후에는 두그룹 모두 프롤리아로 전환해 추가로 12개월간 치료받았다. 공동 1차 유효성평가변수는 12개월 및 24개월까지의 새로운 척추골절의 누적발생률(Cumulative Incidences)이었다.
치료 12개월 시점에서 이베니티TM 투여군의 새로운 척추골절 발생 위험은 0.5%(n=16/3,321)로 1.8%(n=59/3,322)를 기록한 위약군 대비 새로운 척추골절 발생 위험을 73% 낮췄다(p<0.001). 임상적 골절(Clinical Fractures) 발생률은 이베니티 투여군이 1.6%(n=58/3,589)로 위약군 2.5%(n=90/3,591) 대비 36% 골절발생 위험을 낮췄다(p=0.008).
이베니티TM 투여군과 위약군 각각 모두 데노수맙으로 전환해 12개월간 추가치료를 진행한 24개월 시점에서, 이베니티TM투여군의 새로운 척추골절 발생률은 0.6%(n=21/3,325)로 위약군 2.5%(n=84/3,327) 대비 새로운 척추골절 위험을 75%로 유의하게 낮췄다(p<0.001).
ARCH 임상연구에 대하여5
골다공증과 취약성 골절이 있는 폐경후 여성환자 4,093명을 대상으로 진행된 3상 임상연구 (ARCH)에서 이베니티TM는 비스포스포네이트계열 치료제 알렌드로네이트(Alendronate) 대비 우수한 골절예방 효과를 보였다. 임상연구에 참여한 환자들은 월 1회 이베니티TM 투여군과 주 1회 알렌드로네이트 투여군으로 나뉘어 먼저 12개월간 치료받았고, 그후에는 두그룹 모두 알렌드로네이트로 전환하여 치료받았다. 1차 유효성 평가변수는 24개월까지의 새로운 척추골절 발생률과 1차 분석시점(중앙값 33개월 시점)에서의 임상적 골절의 누적발생률이었다.
치료 12개월 시점에서 이베니티™ 투여군(4.0%)은 알렌드로네이트 투여군(6.3%) 대비 새로운 척추 골절 발생 위험은 37% 감소했으며,1차 평가 변수인 치료 24개월 시점에서 이베니티™-알렌드로네이트 투여군(6.2%)은 알렌드로네이트 지속 투여군(11.9%) 대비 48%의 새로운 척추 골절 위험 발생 감소 효과가 나타났다(p<0.001). 1차 분석시점(중앙값 33개월시점)에서의 임상적 골절누적 발생률도 이베니티TM 투여군이 9.7%(n=198/2,046)로 알렌드로네이트 투여군 13%(n=266/2,047) 대비 27% 골절발생 위험을 낮췄다(p<0.001).
STRUCTURE 임상연구에 대하여9
최소 3년간 비스포스포네이트 경구복용 이력이 있고, 1년내 알렌드로네이트(매주 70mg/ 이에 상응하는 용량) 복용경험이 있는 436명의 거동가능한 55-90세 폐경후 골다공증 여성 대상으로 진행한 테리파라타이드(Teriparatide) 대조 3상 임상시험인 STRUCTURE 임상연구 결과, 치료 12개월 시점에 이베니티TM 투여군의 전체고관절(3.4%), 대퇴경부(3.4%), 요추(4.4%) 골밀도가 테리파라타이드 투여군 대비 유의하게 증가한 것으로 나타났다(p<0.0001).
BRIDGE 임상연구에 대하여10
요추나 전고관절, 또는 대퇴골경부의 골밀도 T-score가 –1.5 이하지만 45세 이후에 골절경험이 있거나, T-score가 –2.5 이하인 남성 골다공증 환자 245명을 대상으로 진행된 3상 임상연구(BRIDGE)에서도 이베니티TM는 위약대비 효과적인 골밀도 개선효과를 입증했다.
해당 연구의 1차 유효성 평가변수는 치료 12개월 시점에서 요추골밀도의 변화율이었다. 이베니티TM는 12개월 시점에서 요추골밀도 12.1%, 전고관절골밀도 2.5%, 대퇴골경부골밀도를 2.2% 개선하며 위약대비 수치상 유의미한 골밀도 개선효과를 나타냈다(p<0.05).
암젠(Amgen)에 대하여
암젠은 혁신치료제를 발견, 개발, 제작 및 공급함으로써 심각한 질환으로 고통받고 있는 환자들을 위해 생물학적 가능성을 개발하는데 헌신하고 있다. 이러한 헌신은 질병의 복잡성을 타파하고 인간생물학의 기초를 이해하기 위해 진보된 인간유전학과 같은 도구를 사용하는 것에서 시작한다.
암젠은 많은 의학적 미충족 니즈가 있는 분야에 집중하며 암젠의 전문성을 발휘하여 치료결과를 개선하고 환자들의 삶을 극적으로 개선하고 있다. 1980년부터 바이오기술의 선구자로 자리잡은 암젠은 독립적인 바이오테크회사들의 글로벌리더로 성장하였으며 전세계 수백만명의 환자들과 만나고 파격적인 가능성을 지닌 치료제 파이프라인을 개발하고 있다.
더 자세한 내용은 www.amgen.com에서 확인할 수 있다.
암젠코리아(Amgen Korea)에 대하여
암젠은 골질환, 심혈관질환, 혈액종양/암, 신장질환, 염증질환, 뇌과학, 바이오시밀러 치료제 등을 포함하는 자사의 임상파이프라인을 발전시키고 중증질환으로 고통받고 있는 국내 환자들에게 혁신적인 치료제를 공급하기 위해 2015년 11월 암젠코리아를 설립하였다. 앞으로도 암젠코리아는 생명공학분야의 일원으로, 다양하고 적극적인 활동을 전개하여 국내 제약산업 발전에 기여할 예정이다.
References
1 Teriparatide prescribing information, FDA.
2 Abaloparatide prescribing information, FDA.
3 Rosen CJ.“Romosozumab: Promising or Practice Changing?”,New England Journal of Medicine,2017;377:1479-1480.
4 이베니티™주프리필드시린지 제품설명서(국문)
5 Kenneth G Saag, et al., “Romosozumab or Alendronate for Fracture Prevention in Women with Osteoporosis”,
New England journal of medicine 377, 15 (2017):1417-1427.
6 Felicia Cosman, et al., “Romosozumab Treatment in Postmenopausal Women with Osteoporosis”, New England journal of medicine 375, 16 (2016):1532-1543.
7 대한골대사학회, 골다공증진료지침, 2018
8 Geel V., et al. Clinical subsequent fractures cluster in time after first fracture. Ann Rheum Dis 2009;68:99-102
9 Langdahl BL et al. Romosozumab (sclerostin monoclonal antibody) versus teriparatide in postmenopausal women with osteoporosis transitioning from oral bisphosphonate therapy: a randomized, open-label, phase 3 trial, Lancet 2017;390:1585-1594
10 EM Lewiecki, et al., “Results of a Phase 3 Clinical Trial to Evaluate the Efficacy and Safety of Romosozumab in Men with Osteoporosis”, abstract in 2016 ACR/ARHP Annual Meeting (September 2016).
11 Amgen Korea, Fact Sheet (Korean)