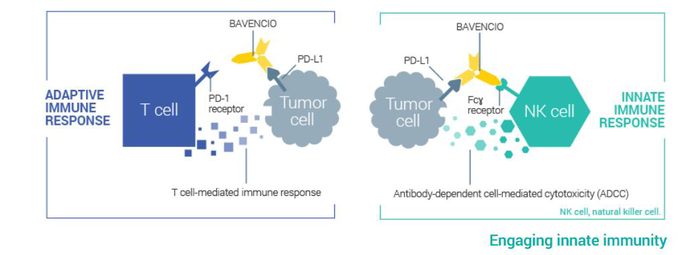
- 전이성 메르켈세포암 치료제로 허가받은 유일한 면역항암제 바벤시오, 식품의약품안전처로부터 시판 허가를 획득하며 국내에서 본격 출시[1],[2]
- JAVELIN Merkel 200 글로벌 임상 통해 치료 옵션이 제한적인 전이성 메르켈세포암 치료제로서의 유효성 및 안전성 확인
한국머크와 한국화이자제약은 항 PD-L1 면역항암제 바벤시오®주(BAVENCIO®, 성분명 아벨루맙)의 기자간담회를 개최하고, 메르켈세포암 질환 현황 및 바벤시오®의 임상적 가치를 조명하는 자리를 마련했다.
이번 기자간담회는 항 PD-L1 면역항암제 바벤시오®주(BAVENCIO®, 성분명 아벨루맙)가 지난 3월 22일부터 성인에서의 전이성 메르켈세포암(mMCC) 치료를 위한 단독요법으로 식품의약품안전처로부터 시판 허가를 획득한 이후2 하반기 국내출시를 기념하기 위해 개최됐다.
바벤시오®주는 FDA와 EU 집행위원회로부터 최초의 전이성 메르켈세포암 치료제로 승인받은 면역항암제로, 주요 임상연구인 JAVELIN Merkel 200를 통해 유효성과 안전성을 인정받아 국내 허가를 받았다.
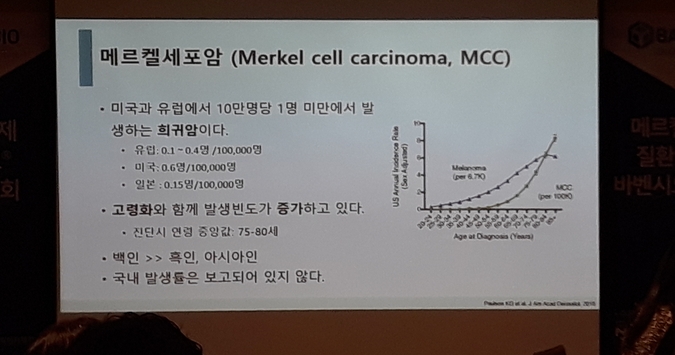
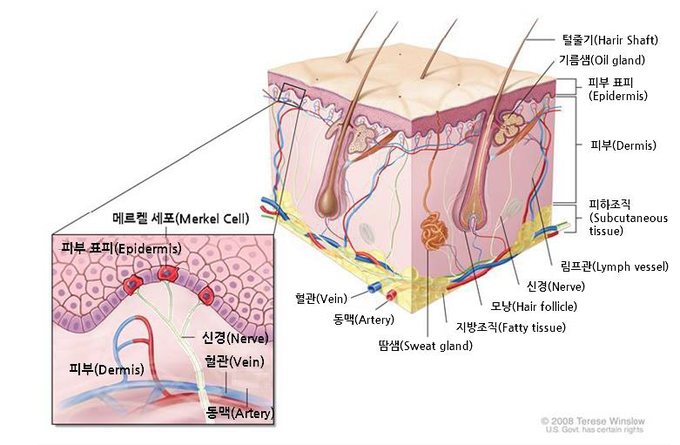
메르켈세포암은 피부 상층부에서 말초신경 가까이에 위치한 메르켈세포의 악성 변화로 진피표피경계에서 발생하며, 질병 관련 사망률이 33%~46%로 추정되는 공격적인 질병이다.[3]
국내에서는 정확한 메르켈 세포암 환자수가 집계된 적은 없지만, 피부암으로 병원에서 진료를 받은 국민이 2012년 4,844 명에서 2017년 7,669명으로 5년 새 58% 가량 증가한 발병 수치가 확인된 바 있다.[4]
이번 기자 간담회에서는 서울대학교암병원 종양내과 김미소 교수가 ‘피부암 및 메르켈세포암 현황 및 질환 소개’를, 한국머크 의학부 메디컬 디렉터 제임스 예(James Yeh) 박사가 JAVELIN Merkel 200를 토대로 바벤시오®주의 임상적 의의 및 가치에 대해 소개했다.
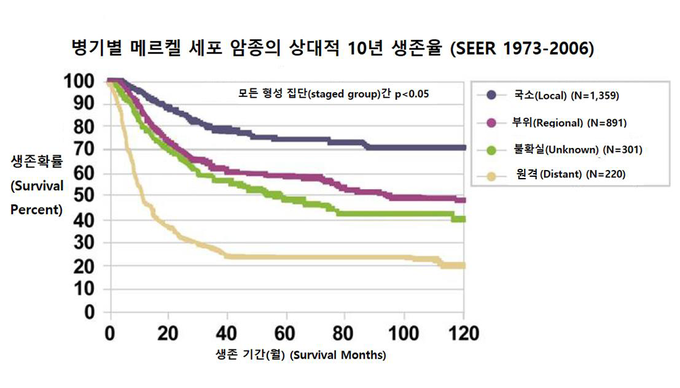
발표를 진행한 김 교수는 “메르켈세포암은 국소림프절 침범 및 원격전이가 매우 빠르게 진행되며, 환자의 평균 생존기간은 약 6개월로 낮은 생존율을 보이는 희귀하고 공격적인 피부암”이라며 “현재 4기 전이성 메르켈세포암 치료 옵션은 제한적이며, 바벤시오®주를 제외한 전이성 메르켈세포암 치료에 대해 허가된 요법은 없는 상황”이라고 설명했다.
이어서 한국머크 의학부 메디컬 디렉터 제임스 예 박사는 바벤시오®주의 주요 임상연구인 JAVELIN 시험의 일부인 JAVELIN Merkel 200을 소개했다.
항암화학요법 후 질환이 진행된 메르켈세포암 환자들을 대상으로 진행한 JAVELIN Merkel 200의 Part A 임상에서 바벤시오®주는 단독요법 후 치료에 따른 질병 반응을 측정하는 객관적 반응률(ORR, Objective Response Rate)이 33.0%에 달했으며, 11.4%는 완전반응을, 21.6%는 부분반응을 보였다.
평균 생존기간(OS, Overall Survival)은 12.9개월이었으며, 분석시점에서 도출된 종양 반응은 93%에서 최소한 6개월 이상 지속적으로 나타났고, 74%는 최소한 12개월 이상 지속적인 반응을 보였다.[5]
치료받은 이력이 없는 전이성 메르켈세포암 환자를 대상으로 진행된 Part B 연구의 중간분석 결과에서는, 39.7%는 객관적 반응을, 13.8%는 완전반응을, 25.9%는 부분반응을 보였으며, 종양 반응의 89%가 3개월 이상, 78%가 6개월 이상 지속됐다.2
한국머크 바이오파마 항암제 사업부 총괄책임 오지영 상무는 “치료 옵션이 제한적인 전이성 메르켈세포암 치료에 유의미한 임상을 통해 효과와 안전성을 확인한 바벤시오®주가 이번 출시를 통해 국내 환자들에게 희망이 되어줄 수 있게되어 매우 기쁘다”며 “한국머크 바이오파마는 앞으로도 전이성 메르켈세포암과 같은 희귀암을 앓고 있는 환자들의 치료 및 삶의 질 개선을 위해 끊임없이 노력하겠다”고 말했다.
한국화이자제약 항암제 사업부 대표 송찬우 전무는 “국내에서 인지도가 낮은 메르켈세포암 치료 분야에 화이자가 머크와의 전략적 제휴를 통해 개발한 바벤시오®주를 새로운 치료 옵션으로 제시하게 되어 기쁘게 생각한다”며 “바벤시오®주가 앞으로 국내 전이성 메르켈세포암 치료 환경에 큰 변화를 가져올 것으로 기대한다”고 전했다.
한편, 바벤시오®주는 머크와 화이자의 전략적 제휴를 통해 전 세계적으로 공동 연구 및 판매되고 있으며, 두 기업은 강점과 역량을 결합하여 면역항암제 개발에 힘쓰고 있다.
바벤시오®주는 지난 2017년 FDA와 EU 집행위원회로부터 최초의 전이성 메르켈세포암 치료제로 승인 받아 미국 및 EU 28개 회원국에서 발매되었으며1,[6], 아시아 국가 중 최초로 일본 후생노동성에서 허가 받은 바 있다.[7]
바벤시오®주(Bavencio®, Avelumab)
바벤시오®주는 성인전이성 메르켈세포암(mMCC) 치료제로 미국 및 유럽에서 최초로 승인받은 항PD-L1 면역항암제다.1,6
해당 적응증은 종양반응 및 반응지속기간(DOR)을 근거로 신속승인되었으며, 적응증에 대한 지속적인 승인은 확정 임상시험의 임상효과 입증 및 설명에 따라 결정될 수 있다.1
(주)머크-화이자 제휴
면역항암제 영역은 머크와 화이자가 최우선 순위로 가치를 두고있는 주요 분야로 양사의 전략적 제휴를 통해 초기 머크가 개발한 PD-L1 항체인 바벤시오®의 공동 연구 및 판매하고 있다. 머크와 화이자는 새로운 암치료 방법을 모색하기 위해 바벤시오®의 단독 및 병용요법 연구를 위해 국제적인임상 프로그램 개발에 집중하고 있다.
References
1 FDA Grants Approval for BAVENCIO® (avelumab), the First Immunotherapy Approved for Metastatic Merkel Cell Carcinoma, March 23, 2017
3 Merkel cell carcinoma: Epidemiology, prognosis, therapy and unmet medical needs, European Journal of Cancer, 2016
4 시도별 신규중증(암)등록환자의 암유형별 진료인원현황,2019
5 Updated efficacy of avelumab in patients with previously treated metastatic Merkel cell carcinoma after ≥1 year of follow-up: JAVELIN Merkel 200, a phase 2 clinical trial, Journal for ImmunoTherapy of Cancer, 2018
6 European Commission Approves Bavencio (avelumab) for Metastatic Merkel Cell Carcinoma, 21 SEP 2017
7 BAVENCIO (AVELUMAB) APPROVED FOR MERKEL CELL CARCINOMA IN JAPAN, Pfizer Newsroom, 2017