• 질병 이환과 치료 기간이 긴 신경내분비종양에서 루타테라 보험급여 적용1으로 환자 삶의 질 고려한 치료 기회 확대와 경제적 부담 감소
• 루타테라, 간 전이 및 종양 크기 등 관계 없이 무진행 생존기간(PFS) 유의미하게 연장, 대조군 대비 질병의 진행과 사망 위험 82% 감소
• 전체 생존기간(OS) 과 환자 삶의 질(QoL) 역시 유의미하게 개선. 대조군 대비OS 12개월 연장 , QoL 최대 84주 개선 으로 전반적인 환자 건강에 긍정적 영향 기대
한국노바티스㈜(대표 유병재)는 신경내분비종양 치료제 루타테라(성분명 루테튬(177Lu)옥소도트레오타이드)가 보건복지부 고시에 따라 2022년 3월 1일부터 절제가 불가능하고 분화가 좋은 소마토스타틴 수용체 양성의 진행성 및/또는 전이성 위장관 신경내분비종양(GI-NET,gastrointestinal neuroendocrine tumour) 성인 환자의 3차 이상, 췌장 신경내분비종양(P-NET, pancreas neuroendocrine tumour) 성인 환자의 4차 이상 치료에서 보험급여가 인정된다고 밝혔다1.
루타테라는 위장관, 췌장 신경내분비종양(GEP-NET) 치료에서 전 세계 최초로 승인된 방사성 리간드 치료제(RLT, radioligand therapy)이다. 종양 세포 표면의 소마토스타틴 수용체(SSTR, somatostatin receptor)에 결합하여 방사선 조사를 통해 표적 종양 세포를 사멸시키는 펩타이드 수용체 방사성핵종 치료제5로, 지난 2020년 7월 국내 허가 받은 바 있다 .
이번 보험 급여는 루타테라의 효능·효과 및 안전성 프로파일을 확인한 제 3상 임상연구인 NETTER-13,4,5 과 제1/2상 임상연구 ERASMUS 등에 기반하여 이루어졌다.
NETTER-1 임상연구에서 일차 평가지표는 무진행 생존기간(PFS, progression-free survival)이었는데, 1차 분석 시점에 대조군(고용량 지속성 옥트레오타이드 투여군)은 8.4개월 인 반면 루타테라 치료군은 중앙값에 도달하지 않아, 대조군 대비 질병의 진행 및 사망 위험을 82% 감소시킨 것으로 나타났다11. 특히, 간 종양이 있는 환자군 전반은 물론 종양 크기에 관계 없이 무진행 생존기간(PFS)를 유의미하게 연장해3 다양한 유형의 환자들에서 효과적인 치료가 가능하다.
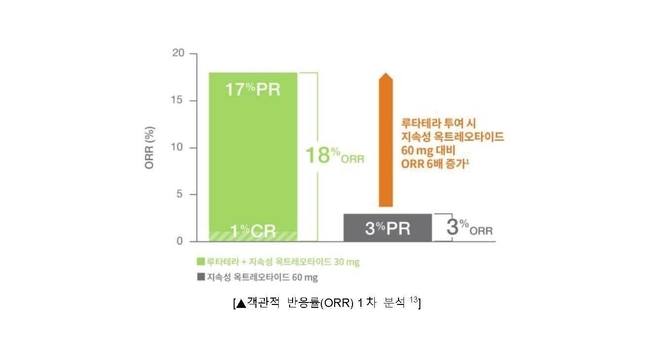
주요 이차 평가지표인 객관적 반응률(ORR, objective response rate)11, 전체 생존기간(OS, overall survival)4, 삶의 질(QoL, quality of life)2,5 등에서도 대조군 대비 유의미한 개선 효과를 보였다. 먼저 루타테라 치료군의 객관적 반응률(ORR)은 18%로 대조군의 3% 대비 약 6배 가량(p<0.001) 증가했다11. 전체 생존기간(OS) 중앙값 역시 루타테라 치료군에서 48.0개월(95% CI: 37.4-55.2), 대조군에서 36.3개월(95% CI: 25.9-51.7)로 약 12개월 가량 연장한 것으로 나타났다4.
위장관, 췌장 신경내분비종양(GEP-NET)을 포함한 신경내분비종양은 기타 종양들과 비교해 상대적으로 질병의 이환과 치료 기간이 길다2. 이는 신체적, 정신적 건강 전반에 영향을 주기 때문에 , 신경내분비종양 치료에서는 환자 삶의 질(QoL) 개선도 중요한 치료 목표 중 하나다.
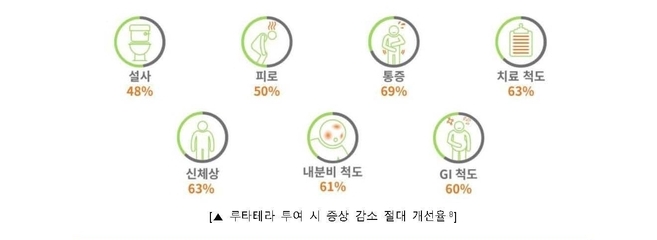
임상연구에 따르면, 루타테라는 환자의 전반적인 건강 관련 삶의 질(QoL) 역시 대조군 대비 최대 84주까지 개선했다2,5. 절대 개선율에서 설사 48%, 피로 50%, 통증 69% 등의 주요 증상들이 모두 감소한 것으로 나타났다2,5.
루타테라는 임상연구 및 장기간 추적 관찰에서 양호한 내약성과 안전성 프로파일을 확인했으며 가장 빈번하게 보고된 이상반응인 오심(58.9%)과 구토(45.5%)의 경우 관리 가능한 수준이었다2.
서울아산병원 종양내과 유창훈 교수는 “일반적으로 신경내분비종양은 희귀암종에 속하며 증상이 시작된 이후 진단까지 평균 5~7년이 소요되며, 환자 1명 당 약 6명의 의료진을 거친 후 정확한 병명을 진단 받는 경우가 많다. 또한 신경내분비종양이 진행되면 치료옵션이 많지 않기 때문에 치료에 어려움을 겪는 경우가 많았다. 루타테라는 현 시점에서 국제적인 표준치료제로서 받아들여지는 필수적인 치료 요법 중 하나이지만 지난 1년 간 한국희귀필수의약품센터를 통해 긴급도입의약품으로서 급여 및 공급이 되었기 때문에 환자들이 루타테라를 투여 받는데 여전히 제한적인 면이 있었다”며, “루타테라가 한국노바티스를 통해 정식 급여 및 공급이 되면서 더 많은 신경내분비종양 환자들이 기존 치료제 대비 상당한 치료 효과와 안전성이 개선된 루타테라의 혜택을 받을 수 있을 것으로 기대된다” 고 말했다.
한국노바티스 항암제 사업부 신수희 대표는 “이번 루타테라 보험급여 적용으로 국내 허가 이후 오랜 시간 지속적인 질병 진행과 긴 치료기간에 지친 신경내분비종양 환자들의 치료 부담 감소와 치료 접근성 마련을 위한 한국노바티스의 노력이 빛을 보게 되어 매우 고무적이다”며, “이번 급여를 계기로 기존에 한정적인 병원에 공급되며 제한적이었던 루타테라 치료 병원 ‘루타센터’를 적극적으로 확대, 접근성을 높이는 등 앞으로도 국내 신경내분비종양 환자들의 치료 기회를 확대하고 더 나은 삶을 제공하기 위해 지속적으로 고민하겠다”고 밝혔다.
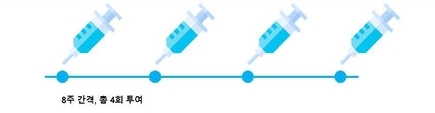
루타테라를 성인 환자에서 권장 용량 7.4GBq를 8주 간격으로 총 4회 투여한다9. 투여는 정맥 주사 방식으로 진행되며 일시 투여가 아닌 약 30분에 걸친 점진적 투여가 필요하다. 또한 루타테라는 방사선 의약품이므로 사용 및 취급에 자격을 갖춘 전문 의료진이 투여해야 한다9.
루타테라에 대하여
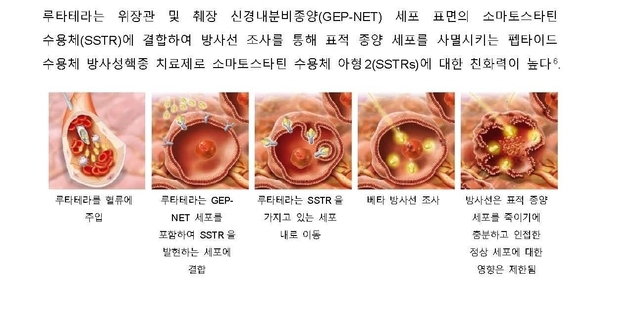
루타테라는 위장관 및 췌장 신경내분비종양(GEP-NET) 세포 표면의 소마토스타틴 수용체에 결합하는 펩타이드 수용체 방사성핵종 치료제로 유럽 및 미국에서 위장관 및 췌장 신경내분비종양(GEP-NET) 치료에 승인된 최초의 방사성 리간드 요법(RLT)이다6,7,8. 혈류에 주입된 루타테라는 위장관 및 췌장 신경내분비종양(GEP-NET) 세포를 포함하여 소마토스타틴 수용체(SSTR)를 발현하는 세포에 결합한 뒤 세포 내로 이동한다5. 이후 베타 방사선을 조사하면 표적 종양 세포를 사멸시키며 인접한 정상 세포에 대한 영향은 제한된다5.
임상연구(NETTER-1 및 ERASMUS)에 대하여
NETTER-1은 무작위, 다기관, 공개, 활성대조군으로 진행된 제 3상 임상연구로 분화된 전이성 분화도가 좋은 중간창자 신경내분비종양을 진단 받은 229명의 환자를 대상으로 진행됐다. 229명의 환자 중 116명의 환자는 8주 간격으로 루타테라를 투여 받았으며 대조군에 포함된 113명의 환자는 4주마다 60mg의 고용량 지속성 옥트레오타이드를 투여 받았다.
[참고: NETTER-1 임상연구 주요 결과]
ㆍ 일차 평가지표
- 1차 분석 시점에서 고용량 지속성 옥트레오타이드군의 무진행 생존기간(PFS)는 8.4개월로 나타난 반면, 루타테라 투여군의 무진행 생존기간(PFS)는 중앙값에 도달하지 않음11
-루타테라 투여군의 질병 진행 또는 사망의 위험은 대조군 대비 82% 감소11
ㆍ 이차 평가지표
- 루타테라 치료군의 객관적 반응률(ORR)은18%로 대조군의 3% 대비 약 6배 가량(p<0.001) 증가11
- 전체 생존기간(OS) 중앙값 역시 루타테라 치료군에서 48.0개월(95% CI: 37.4-55.2), 대조군에서 36.3개월(95% CI: 25.9-51.7)로 약 12개월 가량 연장4
- 루타테라는 환자의 전반적인 건강 관련 삶의 질(QoL) 역시 대조군 대비 최대 84주까지 개선2,5
- 루타테라는 양호한 내약성 및 관리 가능한 안전성 프로파일을 확인2
ERASMUS는 동정적 사용 프로그램의 일환으로 2000년 1월부터 2015년 1월까지 루타테라로 치료 받은 총 1,214명 환자에 대한 분석 연구다10.
[참고: ERASMUS연구 주요 결과]
ㆍ전체 환자군의 객관적 반응률(ORR)은 39%였으며 환자의 43%가 안정적인 질환 상태에 도달10
ㆍ 모든 환자에서 무진행 생존기간(PFS)는 29개월[95% CI, 26-33개월], 전체 생존기간(OS)는 63개월[95% CI, 55-72 개월] 10
ㆍ 치료와 관련된 장기간 및 간 기능 부전이 발생하지 않는 등 안전성 프로파일을 확인10
노바티스(Novartis)에 대하여
노바티스는 인류의 생명 연장과 삶의 질 개선을 목표로 치료제의 새로운 정의를 세우고 있다. 업계를 선도하는 세계적인 제약 기업 노바티스는 최첨단 과학기술과 디지털 기술을 접목하여 사회와 환자가 필요로 하는 혁신적인 의약품 개발에 앞장서고 있으며, 매년 세계에서 R&D에 가장 많은 투자를 하는 기업 순위에 이름을 올리고 있다. 노바티스의 의약품으로 치료 받는 인구는 전 세계적으로 약 8억여명에 달하며 최신 의약품에 대한 환자 접근성을 높이는 혁신적인 방안들을 도입하고자 하는 노바티스의 노력은 현재도 계속되고 있다. 전 세계 각지에서 140여개 국가 출신 110,000명의 노바티스 임직원들이 근무하고 있다. 보다 자세한 내용은 www.novartis.com에서 확인할 수 있다.
한국노바티스(Novartis Korea)에 대하여
세계적인 제약바이오기업, 노바티스의 자회사인 한국노바티스(www.novartis.co.kr)는 계열사인 한국산도스를 포함해 약 580여 명의 직원을 두고 있다. 한국노바티스는 지난 10년 간 한국에서만 약 200 여 건 이상의 임상시험을 진행하여 국내 연구진과의 협력을 활발히 진행하고 있다. 또한, 환우 및 가족 정서 지원 프로그램인 ‘치유(CHEER YOU)’, 여성 암환자 지원 프로그램인 ‘가화맘사성’과 매년 전 직원이 자원봉사활동에 참여하는 ‘지역 봉사의 날’ 행사 등 다채로운 사회공헌활동과 함께 바이오 및 디지털헬스 분야 우수기업을 발굴하고 지원하기 위해 ‘헬스엑스 챌린지 서울’ 공모 프로젝트를 진행하는 등 지역 사회와 국내 헬스케어 산업에 이바지하는 기업이 되기 위해 최선을 다하고 있다.
References
1 보건복지부 고시 제2022-50호, 「약제 급여 목록 및 급여 상한금액표」 일부개정, 2022년 2월 25일
2 Strosberg J, Wolin E, Chasen B, et al. Health Related Quality of Life in Patients With Progressive Midgut Neuroendocrine Tumors Treated With 177Lu-Dotatate in the PhaseIll NETTER-1 Trial. Clin Oncol 2018; 36: 2578‒2584.
3 Strosberg J, Kunz PL, Hendifar A et al. Impact of liver tumour burden, alkaline phosphatase elevation, and target lesion size on treatment out comes with(177)Lu-Dotatate: ananalysis of the NETTER-1 study. Eur J Nucl Med Mol Imaging. 2020;47(10):2372‒2382
4 Strosberg J, Caplin M, Kunz P et al. Final overall survival in the phase 3 NETTER-1 study of 177Lu-DOTATATE in patients with midgut neuroendocrine tumors. Poster 4112. ASCO; June 4–8, 2021
5 LUTATHERA® Summary of Product Characteristics. January 2021.
6 Hennrich U and Kopka K. Lutathera: The First FDA-and EMA Approved Radio pharmaceutical for Peptide Receptor Radionuclide Therapy. Pharmaceuticals 2019;12(3):114. 2. 3.
7 U.S. Food & Drug Administration. FDA approves new treatment for certain digestive tract cancers.
8 European Medicines Agency. Recommendation for maintenance of orphan designation at the time of marketing authorisation.
9 식품의약품안전처 의약품상세정보, 루타테라주(루테튬(177Lu) 옥소도트레오타이드), 2020.07.09
10 Tessa Brabander, Wouter A. van der Zwan, Jaap J.M. Teunissen, Boen L.R. Kam et al. Long-Term Efficacy, Survival, and Safety of [177Lu-DOTA0,Tyr3]octreotate in Patients with Gastroenteropancreatic and Bronchial Neuroendocrine Tumors, Clin Cancer Res 2017; 23(16); 4617–24.
11 Strosberg J, El-Haddad G, Wolin E et al. Phase 3 trial of 177 Lu-dotatate for rmidgut neuroendocrine tumors. N Engl J Med. 2017 January 12; 376(2): 125–135
12 Keizer AC, Korse TC,Meijer WG et al. The effect of delay in diagnosis in patients with neuroendocrine tumors. Int J Endocrin Ocol. 2016;3:33‒39.