두필루맙, 6~11세의 조절되지 않는 중등도-중증 소아 천식 환자 대상 중증 천식 악화 감소 및 폐 기능과 천식 증상 조절 개선 효과 확인
두필루맙의 소아 천식 치료에 대한 미국 FDA의 적응증 확대 근거가 된 데이터로 EMA 또한 심사 진행 중…
2022년 1분기 결과 발표 예상
사노피-아벤티스 코리아(대표 배경은, 이하 사노피)는 6-11세의 조절되지 않는 중등도-중증 소아 천식 환자를 대상으로 한 두필루맙의 3상 임상시험이 ‘뉴 잉글랜드 저널 오브 메디슨(New England Journal of Medicine, 이하 NEJM)’에 게재됐다고 밝혔다.
두필루맙의 해당 임상 데이터는 미국 식품의약국(FDA)으로부터 소아 천식 치료에 대한 적응증 확대의 근거로 활용되었으며, 유럽의약품청(EMA) 또한 2022년 1분기 내에 결정을 내릴 것으로 예상된다.
NEJM에 게재된 이번 LIBERTY ASTHMA VOYAGE 임상시험은 6-11세의 조절되지 않는 중등도-중증 소아 천식 환자 408명을 대상으로 한 무작위 이중맹검 위약-대조 임상시험으로, 천식의 표준치료요법과 두필루맙을 병용 투여했을 때의 효과와 안전성을 평가했다. 두필루맙은 표준치료요법과 병용투여시 호산구성 천식 혹은 호기산화질소(FeNO) 수치가 높게 나타나는 천식 환자에서 중증 천식 악화를 유의하게 감소시켰으며, 폐 기능 또한 투여 2주부터 빠르게 개선시키는 것으로 나타났다.
해당 임상시험에서 두필루맙은 기존에 승인된 12세 이상의 조절되지 않는 중등도-중증 천식 환자에서 밝혀진 안전성 프로파일과 유사한 결과를 보였으며, 두필루맙 투여군의 2.2%와 위약군의 0.7%에서 연충 감염이 추가적으로 보고되었다. 52주의 연구 기간 동안 보고된 이상반응 발생률은 두필루맙 투여군과 위약군 각각 83%, 80%로 비슷하게 나타났으며, 두필루맙 투여군에서 더 흔히 관찰된 가장 흔한 이상반응은 주사부위 반응(두필루맙 투여군 18% vs 위약군 13%), 바이러스성 상기도 감염(두필루맙 투여군 12% vs 위약군 10%), 그리고 호산구 증가증(두필루맙 6% vs 위약 1%)이다.
임상시험의 책임연구자이자 밴더빌트대학교 먼로카렐주니어 소아천식연구센터 원장 겸 아동병원 소아과 소속인 레너드 B. 바카리에(Leonard B. Bacharier) 교수는 “NEJM에 두필루맙의 3상 임상시험 결과가 게재된 것은 조절되지 않는 중등도-중증 소아 천식 환자에서 두필루맙이 갖는 중요성과 잠재적인 임상 가치를 확인할 수 있는 일”이라며 “또한 이번 데이터는 대부분의 소아 천식 사례의 원인이 되는 제2형 염증 반응을 해결함으로써 만성 질환으로 고통받는 소아 환자들의 증상을 개선시킬 수 있다는 것을 보여준다”고 전했다.
천식은 소아에게서 나타나는 가장 흔한 만성 질환 중 하나로, 미국을 비롯해 전세계적으로 약 75,000명의 6-11세 소아 환자가 조절되지 않는 중등도-중증 천식을 앓고 있다. 천식은 증상 조절이 어렵기 때문에 기존 표준치료요법인 흡입형 코르티코스테로이드와 기관지확장제를 사용함에도 불구하고 지속적으로 기침이나 천명(쌕쌕거림), 호흡 곤란과 같은 심각한 증상을 경험할 수 있다. 이처럼 증상 조절이 어려울 경우에는 전신 코르티코스테로이드 치료를 여러 차례 받아야 할 수도 있으나, 코르티코스테로이드의 이상반응에 노출될 수 있어 주의가 필요하다.
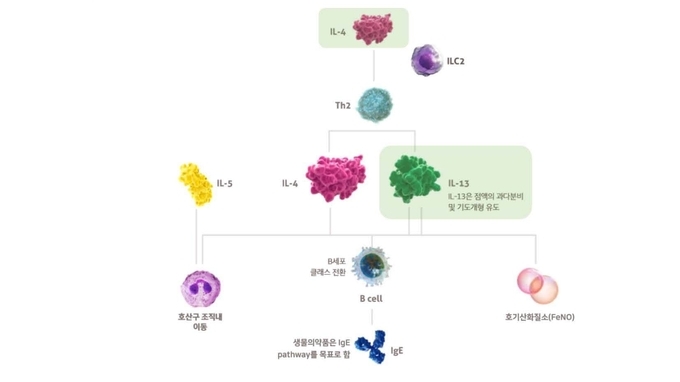
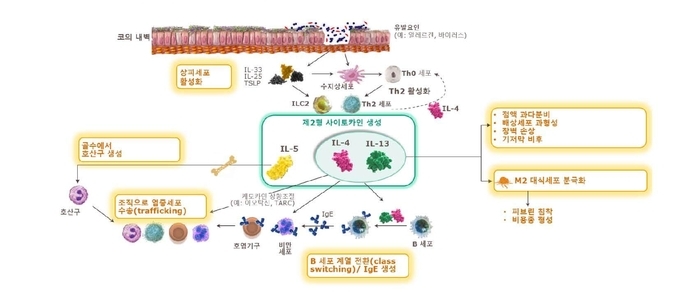
한편, 듀피젠트®는 광범위한 비선택적 면역억제제와 달리 선택적 면역조절제로, 제2형 염증의 주요 원인 물질인 인터루킨-4(IL-4), 인터루킨-13(IL-13)의 신호 전달을 표적하여 조절하는 최초의 생물의약품이며, 제2형 염증성 천식으로 적응증을 획득한 치료제로는 듀피젠트®가 유일하다(2021년 12월 기준).6,7 듀피젠트® 임상 데이터는 IL-4, IL-13이 천식을 비롯해 아토피피부염, 비용종을 동반한 만성 비부비동염의 주요 원인으로 알려진 제2형 염증의 핵심 요인이라는 것을 보여준다.
두필루맙 LIBERTY ASTHMA VOYAGE 임상시험에 대하여
LIBERTY ASTHMA VOYAGE 임상시험은 6-11세의 조절되지 않는 중등도-중증 소아 천식 환자 408명을 대상으로 한 무작위 이중맹검 위약-대조 임상시험으로, 천식의 표준치료요법과 두필루맙을 병용 투여했을 때의 효과와 안전성을 평가했다.(체중 30kg 이하 소아: 100mg 투여 & 체중 30kg 초과 소아: 200mg 투여, 2주 1회 투여) 1차 평가변수는 52주 동안 중증 천식 악화의 연간 발생률이었으며, 2차 평가변수는 투여 12주 시점에서 1초 동안 예측된 강제 호기량(ppFEV1)의 기저점 대비 변화였다.
두필루맙에 대하여,
2018년 3월 식품의약품안전처는 국소치료제로 적절히 조절되지 않거나 이들 치료제가 권장되지 않는 중등도에서 중증 아토피피부염 성인 환자 치료를 위해 두필루맙 국내 시판을 허가했다. 이후 2020년 4월 중등도-중증 청소년 아토피피부염 치료 및 기존 치료에 적절하게 조절되지 않는 청소년 및 성인 중증 호산구성 천식의 추가 유지 치료, 2021년 3월 소아 중등도-중증 아토피피부염 치료 및 기존 치료에 적절하게 조절되지 않는 비용종을 동반한 성인 만성 비부비동염의 추가 유지 치료 요법으로 승인을 받았다. 두필루맙은 사노피와 리제네론이 글로벌 협업 계약에 따라 공동 개발한 의약품이다.
제2형 염증(Type 2 Inflammation)에 대하여
제2형 염증이란 아토피피부염, 천식 등 면역매개 염증성 질환들을 포함하는 넒은 병리생리학적 개념을 뜻한다. 2형염증 질환과 관련해서는 IL-4(인터루킨-4)와 IL-13(인터루킨-13)이 주된 역할을 한다는 사실이 규명된 바 있으며, 이에 두 인터루킨은 제2형 사이토카인으로도 구분된다. 제2형 염증 메커니즘은 아토피피부염, 천식, 만성 비부비동염, 호산구성식도염(EoE) 등 다양한 질환 범위에 영향을 미친다.9
제2형 염증성 천식에 대해여
제2형 염증은 천식 악화의 빈도를 증가시키고 폐 기능을 감소시켜 조절되지 않는 천식(uncontrolled asthma)에 주요한 역할을 하는 것으로 알려져 있다. 성인 천식의 50~70%에 해당하는 제2형 염증성 천식은 비 2형 염증성 천식과 다른 특징으로 구분되어, 2021년 세계천식기구(GINA)는 새 치료 가이드라인을 통해 효과적인 치료를 위해서 제2형 염증성 천식여부를 평가할 것을 권고하고 있다. 아울러 고용량 ICS/LABA 치료를 했음에도 질환이 조절되지 않는 환자에게는 생물의약품 치료가 권고되고 있다.
GINA 가이드라인에 따르면, 제2형 염증성 천식은 고용량의 흡입형 코르티코스테로이드(또는 최소농도의 경구용 코르티코스테로이드) 치료 중에 측정하였을 때 ▲혈중 호산구 ≥ 150 cells/μL객담 내 호산구 ≥2% ▲임상적으로 알레르기 항원에 의해 유발되는 천식 ▲호기 산화질소(FeNO) ≥ 20 ppb ▲유지요법으로 경구용 코르티코스테로이드를 필요로 하는 경우 중 한 가지를 만족할 경우로 정의된다.10
About Sanofi
사노피는 인류가 당면한 건강 문제 해결에 집중하는 글로벌 바이오 제약기업으로, 질병을 예방하는 백신과 통증 및 고통을 경감시키는 혁신적인 의약품을 제공하고 있다. 또한, 소수의 희귀질환 환자뿐만 아니라 수백만의 만성질환 환자 모두를 위해 일하고 있다.
전세계 100개국 10만여 직원과 함께 사노피는 과학적 혁신을 헬스케어 솔루션으로 구현하고 있다. 보다 자세한 정보는 www.sanofi.co.kr에서 확인할 수 있다.
References
8 Gause WC, et al. Nat Rev Immunol 2013;13:607-614.
9 Gandhi NA, et al. Nat Rev Drug Discov. 2016;15(1):35-50.
11 Seys SF, Scheers H, Van den Brande P, et al. Cluster analysis of sputum cytokine-high profiles reveals diversity in T(h)2-high asthma patients. Respir Res. 2017;18:39. doi:10.1186/s12931-017-0524-y
12 Peters MC, Mekonnen BA, Yuan S, et al. Measures of gene expression in sputum cells can identify TH2-high and TH2-low subtypes of asthma. J Allergy Clin Immunol. 2014;133(2):388–394.
Reference