주요 임상인 GEOMETRY mono-1 연구를 통해 높은 객관적 반응률 및 빠른 반응 속도 확인
한국노바티스주식회사(대표:유병재)는 경구용 MET 억제제 타브렉타(Tabrecta, 성분명 카프마티닙)가 MET 엑손 14 결손(skipping)이 확인된 국소 진행성 또는 전이성 비소세포폐암 환자의 치료제로 11월 23일 식품의약품안전처의 허가를 받았다고 밝혔다.
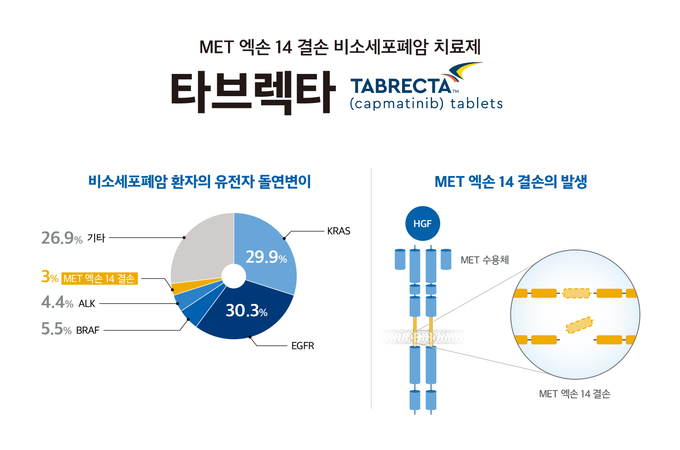
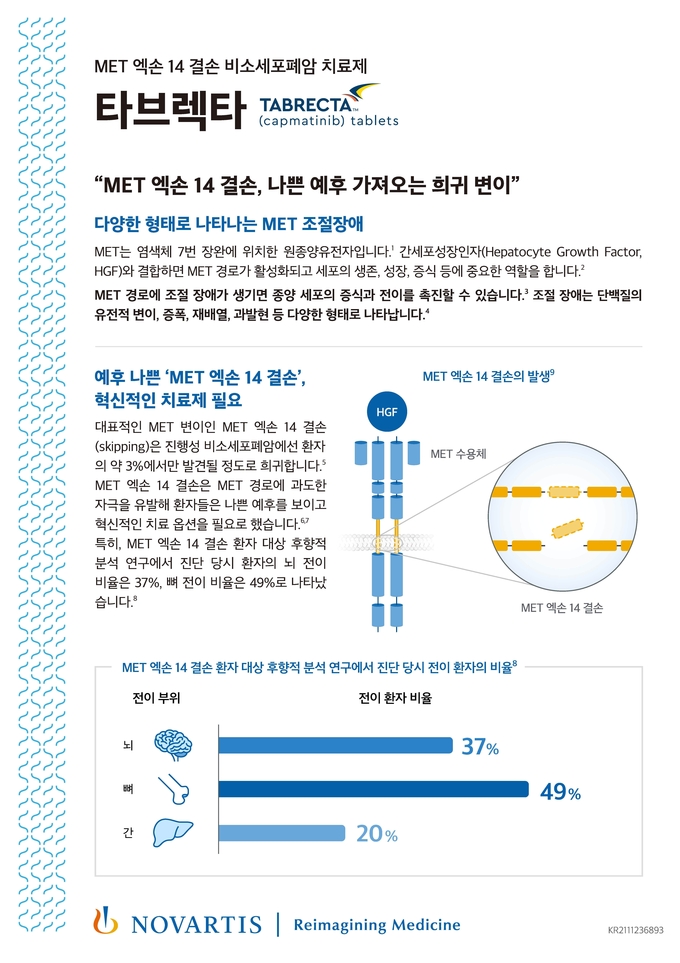
비소세포폐암은 암세포의 성장을 촉진하는 다양한 돌연변이가 존재하며, 염색체 7번 장완에 위치한 원종양유전자인 MET 에도 이상 반응이 나타날 수 있다. MET 유전자에서 발생하는 모든 이상 반응을 MET 조절 장애(dysregulation)라고 하며, 크게 MET 증폭(amplification)과 MET 변이(mutations)로 나뉜다. MET 엑손 14 결손은 대표적인 MET 변이에 해당된다.
MET 엑손 14 결손이 일어나면 세포 신호와 증식, 생존에 중요한 역할을 하는 MET 경로가 과도하게 자극되고 암세포의 증식을 유발한다. MET 엑손 14 결손은 전체 전이성 비소세포폐암 환자의 약 3%에서만 나타날 정도로 흔치 않지만 공격적인 특성 탓에 예후가 좋지 않고, 특히 MET 엑손 14 결손 환자 대상의 후향적 분석 연구에서, MET 엑손 14 결손 환자 중 진단 당시 뇌전이 환자는 37%, 뼈전이 환자는 49%로 나타났다.
타브렉타는 MET 수용체 티로신 키나아제를 선택적으로 억제하는 기전의 약물이다. 세포 내 수용체의 인산화효소 영역에 결합해 MET 인산화 반응을 차단하고 MET이 주요 하위 신호 전달 경로를 비정상적으로 활성화하는 것을 막는다.8 타브렉타는 이러한 기전의 혁신성을 인정받아 2019년 9월 미국 FDA로부터 혁신적 치료제(breakthrough therapy)로 지정, 신속 승인 절차를 거쳐 2020년 5월 FDA의 허가를 받았다.
식품의약품안전처의 이번 허가는 MET 엑손 14 결손이 확인된 97명의 비소세포폐암 환자를 대상으로 한 주요 임상 연구 결과를 바탕으로 이뤄졌다.
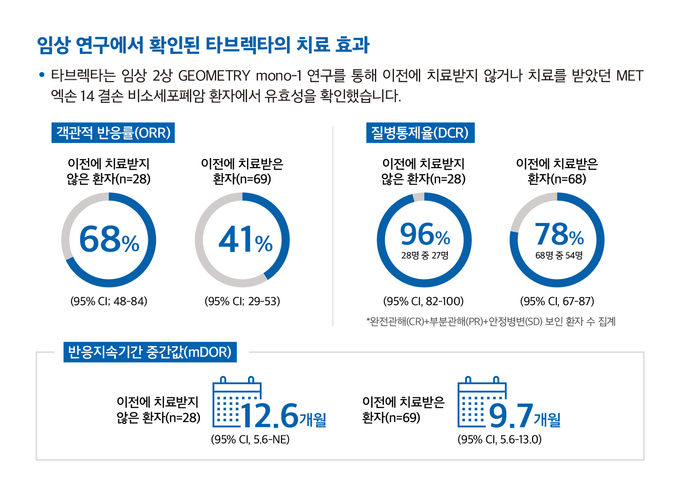
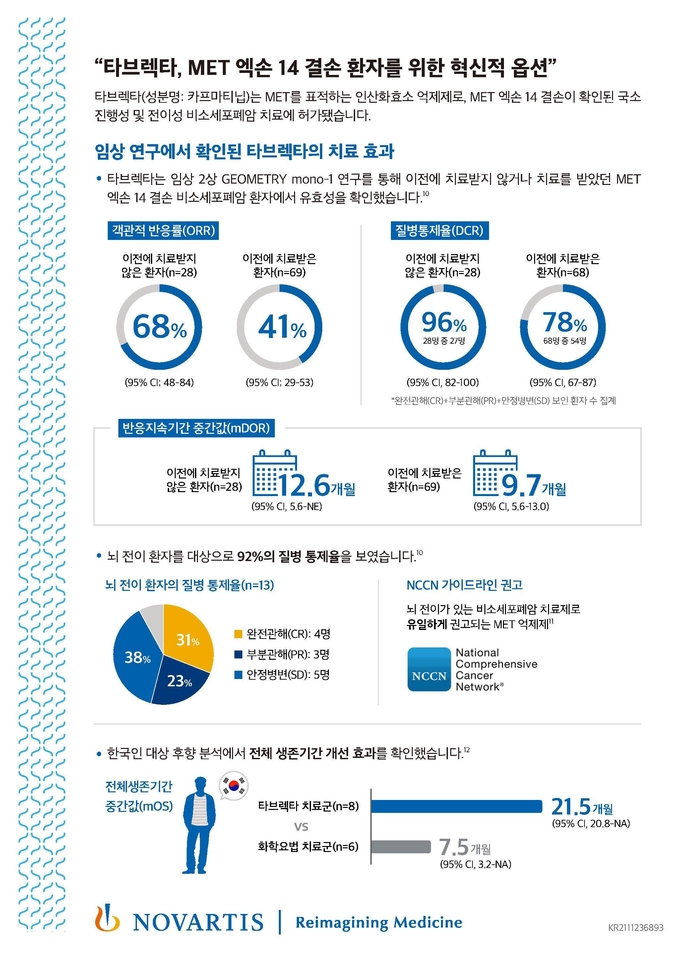
2상 임상 GEOMETRY mono-1 연구에서 타브렉타를 투여한 환자 중 이전에 치료받지 않은 환자에서는 68%(95% CI; 48-84), 이전에 치료를 받은 적이 있는 환자에서는 41%(95% CI; 29-53)의 객관적 반응률(Objective Response Rate, ORR)이 나타났다. 특히, 환자들의 이러한 반응은 빠르게 관찰됐다. 이전에 치료받지 않은 환자의 68%, 이전에 치료를 받은 적이 있는 환자의 82% 등 대부분의 환자가 타브렉타로 치료 시작 후 7주 이내에 반응을 보였다. 이전에 치료받지 않은 환자의 반응지속 기간 중간값(median Duration of Response, mDOR)은 12.6개월(95% CI, 5.6-NE)이었고, 치료받은 환자는 9.7개월(95% CI, 5.6-13.0)이었다.1
완전관해(Complete Response, CR)와 부분관해(Partial Response, PR), 안전병변(Stable Disease, SD)을 보인 환자 수를 모두 집계한 질병통제율(Disease Control Rate, DCR)은 이전에 치료받지 않은 환자에서 96%(95% CI, 82-100)로, 28명의 환자 중 27명의 질병이 통제되고 있는 것으로 확인됐다. 치료를 받은 적이 있는 환자에서는 69명 중 54명의 질병이 통제, 질병통제율은 78%(95% CI, 67-87)인 것으로 나타났다.1 나아가 뇌 전이가 있는 비소세포폐암 환자 13명(이전에 치료받지 않은 환자 3명, 치료를 받은 적이 있는 환자 10명)의 두개 내 병변에 대한 객관적 반응률(intracranial ORR)을 사후 분석한 결과, 완전관해를 보인 4명을 포함해 12명(92%)에서 질병 통제가 확인됐다.1
연구에선 이미 알려진 타브렉타의 안전성 프로파일도 확인됐다. 대부분의 이상반응은 예측 가능한 1, 2등급이었고 용량 조절로 해결할 수 있었다. 가장 빈번하게 보고된 이상반응은 말초부종, 메스꺼움, 구토 및 혈중 크레아티닌 증가 등이었다.1
한국노바티스 항암제 사업부 신수희 대표는 “예후가 좋지 않음에도 마땅한 치료제가 없어 의료적 수요가 높았던 국내 MET 엑손14 결손 비소세포폐암 치료 분야에 타브렉타를 빠르게 도입할 수 있게 돼 매우 기쁘다”며, “정밀항암치료의 시대가 다가온 지금, 주요 임상 연구를 통해 차별화된 효과와 안전성을 보여준 타브렉타가 해당 치료군에 속하는 환자들에게 최선의 선택지로 자리매김하길 바란다”라고 말했다.
신수희 대표는 “한국노바티스는 항암 치료에서 독보적인 리더십과 경험을 가진만큼, 앞으로도 혁신적인 치료제의 공급으로 국내 암 환자들의 치료 혜택을 넓히기 위해 노력할 것”이라고 밝혔다.
타브렉타(Tabrecta)에 대하여
타브렉타(Tabrecta)는 MET를 표적하는 인산화효소 억제제로, 노바티스는 2009년 인사이트(Incyte Corporation)사로부터 타브렉타에 대한 라이선스를 획득했다. 인사이트사는 계약에 따라 글로벌 시장에서 타브렉타 및 타브렉타의 모든 적응증에 사용되는 특정 예비 화합물(back-up compound)의 독점 개발 및 상업화 권리를 노바티스에 부여했다.
GEOMETRY mono-1 연구에 대하여1
GEOMETRY mono-1은 EGFR 변이가 없고, ALK 음성인 전이성 비소세포폐암 환자를 대상으로 진행된 중추적, 다기관, 비무작위배정, 개방표지, 다중코호트의 임상 2상 연구이다.
연구에서 MET 엑손 14 결손을 보이는 97명의 성인 전이성 비소세포폐암 환자들은 코호트4(이전에 치료를 받은 환자, n=69) 또는 코호트 5b(이전 치료 경험이 없는 환자, n=28)로 배정돼 타브렉타를 1일 2회, 1회 400mg을 경구 복용했다. 치료는 환자가 더 이상 약물에 반응하지 않거나, 질병의 진행이 확인될 때까지 또는 연구자 주도로 중단될 때까지 계속됐다. 평가 가능한 환자는 최소 6번의 치료 주기(18주)를 완료한 환자로 정의된다.
1차 유효성 평가 변수는 고형암 반응평가기준인 RECIST(Response Evaluation Criteria In Solid Tumors) 1.1에 따라 맹검독립평가위원회(BIRC)가 결정한 객관적 반응률(ORR)이었다. 주요 2차 유효성 평가 변수는 BIRC에 따른 반응지속기간(DOR)이었다.
폐암에 대한 노바티스의 헌신
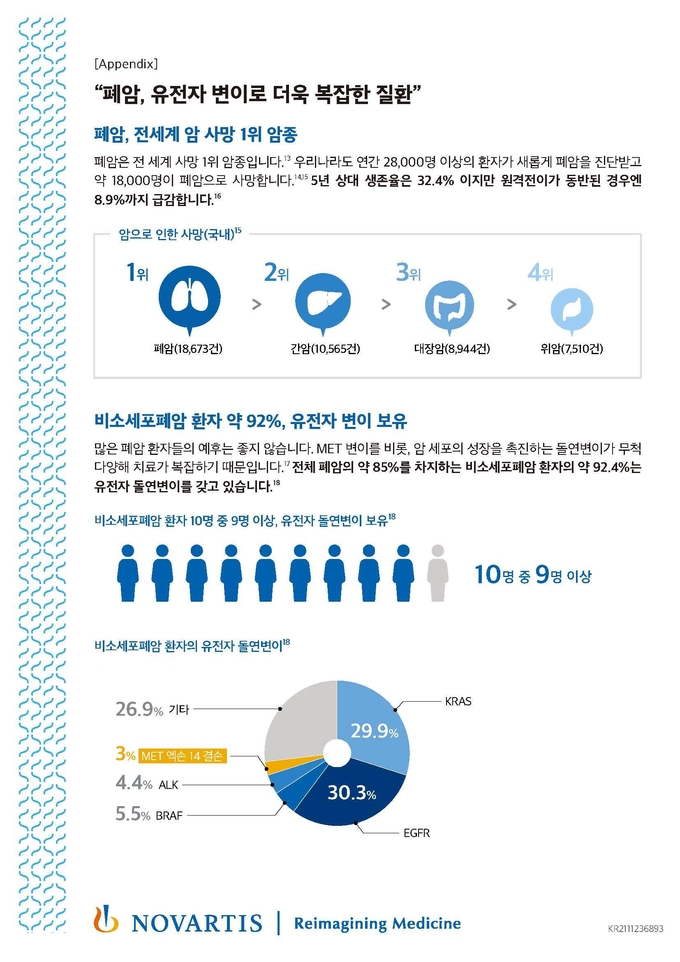
전 세계적으로 매해 220만 건 이상의 폐암이 새롭게 진단된다. 폐암으로 인한 사망은 대장암, 간암으로 인한 사망을 합한 것보다 더 많이 발생한다. 치료의 발전에도 불구하고 많은 비소세포폐암 환자들의 예후는 여전히 좋지 않고 치료 옵션도 제한돼 있다. 비소세포폐암 환자 중 유전자 돌연변이를 가진 약 92.4%도 여기에 해당된다. 이들에게 가장 적절한 치료가 무엇인지 판단하기 위해 의료 단체들은 초기 진단 시 종합적인 유전체 검사를 권고하고 있다.
노바티스 항암제 사업부는 연구를 통해 비소세포폐암 환자들의 치료 접근법 전환에 기여하고 있다. 현재 다양한 연구를 진행 중일뿐만 아니라 유전적 바이오마커 및 종양 촉진 염증 표적 물질 등 비소세포폐암 내 여러 시험용 화합물들을 탐구하는 등 전세계 폐암 커뮤니티를 위한 노력에 힘쓰고 있다.
한편, 국내에 승인된 약제로는 2020년 2월부터 보험 급여 적용되고 있는 BRAF V600E 변이 비소세포폐암 치료제 라핀나/매큐셀과 이번에 승인된 타브렉타가 있다.
노바티스(Novartis)에 대하여
노바티스는 인류의 생명 연장과 삶의 질 개선을 목표로 의약품 혁신에 매진하는 세계적인 제약 기업이다. 업계를 선도하는 노바티스는 최첨단 과학기술과 디지털 기술을 접목하여 사회와 환자가 필요로 하는 혁신적인 의약품 개발에 앞장서고 있으며, 매년 세계에서 R&D에 가장 많은 투자를 하는 기업 순위에 이름을 올리고 있다. 노바티스의 의약품으로 치료받는 인구는 전 세계적으로 약 10억여명에 달하며 최신 의약품에 대한 환자 접근성을 높이는 혁신적인 방안들을 도입하고자 하는 노바티스의 노력은 현재도 계속되고 있다. 전 세계 각지에서 140여개 국가 출신 125,000명의 노바티스 임직원들이 근무하고 있다. 보다 자세한 내용은 www.novartis.com에서 확인할 수 있다.
한국노바티스(Novartis Korea)에 대하여
세계적인 제약•바이오기업, 노바티스의 자회사인 한국노바티스(www.novartis.co.kr)는 계열사인 한국산도스를 포함해 약 580여 명의 직원을 두고 있다. 한국노바티스는 지난 10년 간 한국에서만 약 200 여 건의 임상시험을 진행하여 국내 연구진과의 협력을 활발히 진행하고 있으며, 환우 및 가족 정서 지원 프로그램인 ‘치유(CHEER YOU)’, 환우의 사회 복귀 지원 프로그램 ‘이음’, 여성 암환자 지원 프로그램인 ‘가화맘사성’과 매년 전 직원이 자원봉사활동에 참여하는 ‘지역 봉사의 날’ 행사 등 다채로운 사회공헌활동을 통해 지역 사회에 이바지하는 기업이 되기 위해 최선을 다하고 있다.
References
1 J Wolf, et al. Capmatinib in MET Exon 14–Mutated or MET-Amplified Non–Small-Cell Lung Cancer. N Engl J Med 2020; 383:944-957.
2 식품의약품안전처 의약품안전나라 의약품통합정보시스템, 타브렉타정
3 Smyth EC, et al. Emerging molecular targets in oncology: clinical potential of MET/hepatocyte growth-factor inhibitors. Onco Targets Ther. 2014;7:1001-1014.
4 MA Socinski, et al. MET Exon 14 Skipping Mutations in Non–Small-Cell Lung Cancer: An Overview of Biology, Clinical Outcomes, and Testing Considerations. JCO Precis Oncol. 2021; 5: PO.20.00516.
5 Drilon AD, et al. Targeting MET in Lung Cancer: Will Expectations Finally Be MET? J Thorac Oncol. 2017;12(1):15-26.
6 Feng Y, et al. MET signaling: novel targeted inhibition and its clinical development in lung cancer. J Thorac Oncol. 2012;7:459-467.
7 Vuong HG, et al. Clinicopathological implications of MET exon 14 mutations in non-small cell lung cancer – a systematic review and meta-analysis. Lung Cancer. 2018;123:76-82.
8 Vansteenkiste JF, et al. Capmatinib for the treatment of non-small cell lung cancer. Expert Rev Anticancer Ther. 2019;19(8):659-671.
9 Awad MM, et al. Impact of MET inhibitors on survival among patients with non-small cell lung cancer harboring MET exon 14 mutations: a retrospective analysis. Lung Cancer. 2019;133:96-102.
10 Awad MM, et al. Impact of MET inhibitors on survival among patients with non-small cell lung cancer harboring MET exon 14 mutations: a retrospective analysis. Supplementary Table 2. Lung Cancer (suppl). doi.org/10.1016/j.lungcan.2019.05.011.
13 Cappuzzo F, et al. Increased MET gene copy number negatively affects survival of surgically resected non-small-cell lung cancer patients. Journal of Clinical Oncology. 2009;27:1667-1674.
14 A Addeo, et al. Immunotherapy in non-small cell lung cancer harbouring driver mutations. Anti-Tumor Treatment, volume 96, 102179, May 01, 2021.
15 Sadiq AA, Salgia R. MET as a possible target for non-small-cell lung cancer. Journal of Clinical Oncology. 2013;31:1089-1096.