- 제줄라®, 첫 번째로 HRd(상동재조합결핍) 여부, BRCA 변이와 같은 바이오마커와 관계없이 백금기반요법에 반응한 난소암 1차 유지요법에서 사용할 수 있는 PARP 억제제
- PRIMA 임상, HRd 환자군에서 위약 대비 약 2배 이상 개선된 무진행생존기간 중앙값과 질병의 진행 및 사망에 대한 위험률도 57% 감소 확인
- 국내 허가된 PARP 억제제 중 첫 번째로 1일 1회 복용이 가능해 환자 편의성까지 제고1
한국다케다제약(대표 문희석)은 9월 10일 난소암 치료제 제줄라®(성분명: 니라파립)의 난소암 1차 유지요법 적응증 확대 기념 기자간담회를 개최하고, 제줄라®의 임상적 유효성에 대해 소개하는 자리를 마련했다고 밝혔다.
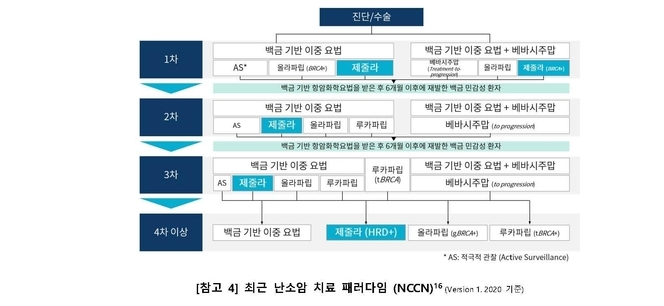
제줄라®는 최초로 BRCA 변이 여부와 상관없이 사용할 수 있는 PARP 억제제로,1 이번 적응증 확대를 통해 국내 첫 번째로 BRCA 변이 등의 바이오마커와 관계없이 백금기반요법에 반응한 난소암 환자의 1차 유지요법에서 사용할 수 있게 되었다.1 또한 1차부터 4차 이상까지 난소암 치료의 모든 단계에서 허가 받은 국내 첫 번째 PARP 억제제가 됐다.1
첫번째로 ‘제줄라®의 혁신적인 기전 및 주요 임상 결과’ 소개를 맡은 한국다케다제약 의학부 조백설 항암제 및 희귀혈액질환제 총괄은 “제줄라®는 이미 NOVA, QUADRA 등 주요 임상을 통해 난소암 2차 이상 유지요법 및 4차 이상 치료요법에서 유효성과 안전성 프로파일을 확인한 약제다.1,3, 제줄라®는 약물이 순환 혈류에 흡수되는 비율인 생체이용률(Bioavailability)이 최대 73%으로 높고 평균 반감기가 36시간으로 길며, 광범위한 조직분포를 보인다는 특징이 있다.1 이로 인해 국내 허가된 PARP 억제제 중 최초로 1일 1회 복용이 가능해, 환자들의 복약 편의성 및 순응도가 개선되는 데 도움을 줄 수 있는 약제” 라고 설명했다.1
두번째로, 1차 유지요법 적응증 확대의 근거가 된 PRIMA 임상 연구 책임자인 안토니오 곤잘레스 마틴 교수(스페인 나바라 대학병원)가 ‘난소암 1차 유지요법에서 확인한 제줄라®의 유효성’을 주제로 발표를 진행했다.
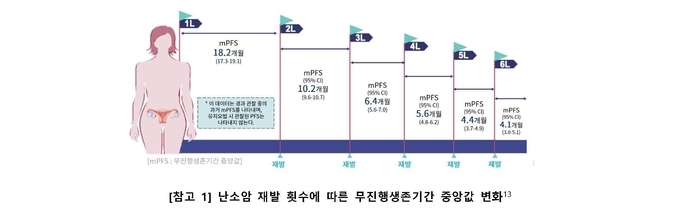
안토니오 곤잘레스 교수는 “PRIMA 임상 연구 결과, HRd 환자군에서 제줄라®군의 무진행생존기간 중앙값은 21.9개월로, 위약군과 비교해 2배 이상 효과를 보였으며, (제줄라®군 21.9개월 vs 위약군 10.4개월) 질병의 진행 및 사망에 대한 위험률 또한 위약군 대비 57% 감소시켰다.2 (HR 0.43; 95% CI, [0.31 to 0.59]; P<0.001) 특히 PRIMA 연구에는 재발 위험성이 높은 환자들이 포함되었음에도 불구하고, 제줄라®는 HRd 여부, BRCA 변이와 같은 바이오마커와 관계없이 모든 환자군에서 효과를 확인했다.2 실제 처방 현장에서도 임상 데이터보다 더 좋은 경과를 기대해 볼 수 있을 것”이라고 강조했다.
이어 서울성모병원 산부인과 허수영 교수는 ‘국내 제줄라® 1차 유지요법 적응증 확대의 의의’를 주제로 발표했다.
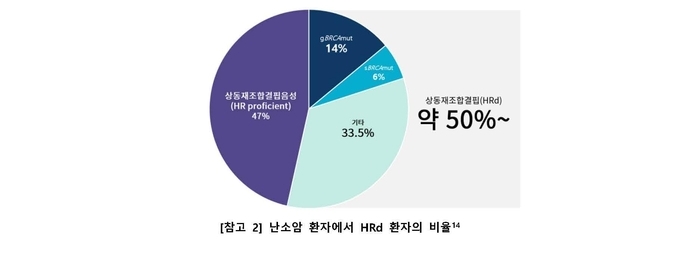
허수영 교수는 “난소암은 다른 여성암과 다르게 검진이 어려울 뿐만 아니라, 환자의 약 85%가 재발을 경험하는 등 예후가 좋지 않다. 난소암 환자의 약 15%가 BRCA 변이를 보이며, 항암화학요법 치료 후 PARP 억제제로 유지요법을 받고 있지만, BRCA 변이가 없는 약 85% 환자는 유지요법 옵션이 없었기에 매우 안타까웠다.5 최근 국내 난소암 진료 권고안에서도 1차 유지요법에서 PARP 억제제의 사용이 권고되고 있는만큼, BRCA 변이 여부와 관계없이 사용가능한 PARP 억제제 ‘제줄라®’의 적응증 확대는 의의가 매우 크다. 1 안전성 프로파일 관련 용량 조절 지침이 존재하기 때문에 이상반응에 따른 관리가 용이한데다, 1일 1회만 복용 가능해 환자들의 편의성을 크게 높인 약제다.1 난소암 치료 옵션이 제한적이었던 상황에서, 더 많은 환자가 효과적인 치료 혜택을 경험할 수 있도록 적응증을 확대한 제줄라®에 대한 기대가 크다”고 강조했다.
한국다케다제약 문희석 대표는 “제줄라®의 적응증 확대를 통해 1차에서부터 4차 이상까지 다양한 난소암 환자들에게 혁신적인 약제를 제공할 수 있게 돼 매우 기쁘다. 한국다케다제약은 작년 3월 제줄라® 허가 이후,1 빠른 약제 공급과 적응증 확대 및 접근성 개선 등 난소암 환자에게 필요한 부분이 무엇인지 늘 고민하고 최선을 다하고 있다. 지속해서 난소암 환자들의 어려움을 이해하고, 더 좋은 치료 환경과 삶의 질 개선을 위해 꾸준히 노력할 예정이다”고 말했다.
제줄라®는 최초로 BRCA 변이 여부와 관계없이 사용할 수 있는 PARP 억제제로,1,3 18세 이상의 2차 이상 백금기반요법에 반응한 백금민감성 재발성 gBRCA 변이 고도 장액성 난소암 환자(난관암 또는 일차 복막암 포함)에서 백금계 항암제 완료 후 8주 이내 투약 시 급여 적용이 가능하다.
제줄라®(Zejula)에 대하여
제줄라®는 BRCA 변이 여부와 관계없이 사용할 수 있는 최초의 PARP(poly ADP-ribose polymerase) 억제제1,3로 항암전문 바이오제약사인 테사로(Tesaro)가 임상 개발을 진행한 치료제다.
2016년 미국 FDA로부터 백금기반 화학요법에 완전 혹은 부분 반응을 보이는 재발성 상피세포 난소암, 나팔관암, 원발성 복막암 성인 환자의 유지요법 치료제로 신속 심사 대상(Fast Track designation)에 선정됐으며 2017년 3월 미국 FDA 허가를 받았다.
국내에서는 2018년 4월 희귀의약품으로 지정됐으며 2019년 3월 식품의약품안전처에서 품목 허가1를 획득했고, 지속해서 적응증을 확대해가고 있다.
현재 ▲ 1차 백금기반 항암화학요법에 반응(부분 또는 완전반응)한 난소암(난관암 또는 일차 복막암 포함) 성인 환자의 단독 유지요법 치료제 ▲ 2차 이상의 백금기반 항암화학요법에 반응(부분 또는 완전반응)한 백금민감성 재발성 고도장액성 난소암(난관암 또는 일차 복막암 포함) 성인 환자의 단독 유지요법 ▲ 이전에 3차 이상의 항암화학요법을 투여 받은 적이 있는 1) BRCA 변이(백금 민감성 여부에 무관) 또는 2) 백금 민감성 상동재조합결핍 (HRD) 양성인 재발성 난소암(난관암 또는 일차 복막암 성인 환자 포함)의 단독 치료 요법으로 허가를 받았다.1 또한 2019년 12월부터 BRCA 변이 고도 장액성 난소암 환자에서 급여 적용이 가능하다.8
다케다제약은 2017년 7월 테사로와 판매 라이선스 계약을 통해 한국을 포함한 아시아 4개 국에서 전립선암을 제외한 모든 암종에서 제줄라®의 개발 및 판매 권리를 취득했다. 2019년 GSK가 테사로를 인수하면서 이에 따라 제줄라®의 글로벌 판권은 GSK가, 국내 판권은 한국다케다제약이 보유하고 있다.
다케다제약(Takeda Pharmaceutical Company Limited)
다케다제약은 글로벌 가치 기반 연구개발 중심의 바이오제약 선두기업으로, 일본에 본사를 두고 있다. 다케다제약은 의약품 혁신을 통해 환자들의 보다 건강한 삶과 더 나은 미래(Better Health, Brighter Future)를 만들어 가기 위해 헌신하고 있다. 특히 항암제, 위장관질환, 신경계질환, 희귀질환 등 4대 핵심 치료 분야 연구에 집중하고 있다. 또한 혈장유래제제 및 백신의 연구개발에도 투자하고 있다. 다케다제약은 새로운 치료 옵션을 발전시키고 탄탄한 파이프라인을 구축할 수 있는 역량 및 연구개발 협력을 통해 전세계 많은 이들의 삶에 긍정적인 영향을 줄 수 있는 혁신적인 신약 개발에 정진하고 있다. 임직원은 전세계 약 80개국에서 다양한 헬스케어 파트너와 협력하며 환자들의 삶의 질 향상을 위해 헌신하고 있다. 더 자세한 정보는
https://www.takeda.com에서 찾을 수 있다.
한국다케다제약㈜
한국다케다제약은 싱가포르에 위치한 다케다제약 아시아태평양 지역본부 소속으로, 2011년 4월 국내에 설립돼 한국 내 마케팅 및 영업을 영위해 오고 있다. 한국다케다제약은 환자의 건강 증진을 최우선으로 하는 기업 이념과 ‘성실(Integrity)’의 핵심 가치를 기반으로 엄격한 윤리기준을 준수하며 의약품과 관련 정보를 제공하고 있다.
References
2 González-Martín, A. et al. Niraparib in patients with newly diagnosed advanced ovarian cancer. N. Engl. J. Med. 381, 2391–2402 (2019).
3 Mirza MR et al. Niraparib maintenance therapy in platinum-sensitive, recurrent ovarian cancer. N. Engl. J. Med. 2016; 375: 2154–64.
4 Moore KN, et al. Niraparib monotherapy for late-line treatment of ovarian cancer (QUADRA): a multicentre, openlabel, single-arm, phase 2 trial. Lancet Oncol 2019;20:636-48.
6 Lorusso D et al. The role of secondary surgery in recurrent ovarian cancer. Int J Surg Oncol. 2012;613980.
7 대한부인종양학회 35차 춘계학술대회 발표 영상, 4차 난소암 진료 권고안
8 암환자에게 처방•투여하는 투여하는 약제에 대한 공고 개정 안내, 건강보험심사평가원, 공고 제2019-331호, available at
http://www.hira.or.kr/bbsDummy.do?pgmid=HIRAA020002000100&brdScnBltNo=4&brdBltNo=7583&pageIndex=3#none, accessed on 25 Aug 2020
9 ESMO, Oncology news, NIRAPARIB RECEIVES FDA FAST TRACK DESIGNATION FOR THE TREATMENT OF RECURRENT PLATINUM-SENSITIVE OVARIAN, FALLOPIAN TUBE, OR PRIMARY PERITONEAL CANCER, September 15, 2016,
https://www.esmo.org/Oncology-News/Niraparib-Receives-FDA-Fast-Track-Designation-for-the-Treatment-of-Recurrent-Platinum-Sensitive-Ovarian-Fallopian-Tube-or-Primary-Peritoneal-Cancer, accessed on 25 Aug 2020
10 Niraparib (ZEJULA), Resources for Information on Approved Drugs, FDA homepage, available at:
https://www.fda.gov/drugs/resources-information-approved-drugs/niraparib-zejula accessed on 25 Aug 2020
11 식품의약품안전처 고시 제2018-22호, 희귀의약품 지정에 관한 규정 일부개정고시 available at:
https://www.mfds.go.kr/brd/m_211/view.do?seq=13961&srchFr=&srchTo=&srchWord=&srchTp=&itm_seq_1=0&itm_seq_2=0&multi_itm_seq=0&company_cd=&company_nm=&page=20 accessed on 25 Aug 2020
12 Takeda Press Release, July 27, 2017,
https://www.takeda.com/newsroom/newsreleases/2017/tesaro-and-takeda-enter-into-exclusive-licensing-agreement-to-developand-commercialize-novel-cancer-therapy-niraparib-in-japan/, accessed on 25 Aug 2020
13 GSK Press release, January 22, 2019,
https://kr.gsk.com/ko-kr/gsk-%EC%86%8C%EC%8B%9D/%EB%B3%B4%EB%8F%84%EC%9E%90%EB%A3%8C/2019/20190130/, accessed on 25 Aug 2020