절제불가 3기 비소세포폐암 진료지침 및
면역항암제 급여기준 업데이트의 배경이 된 임핀지의 임상적 근거 조명
미국(NCCN)과 유럽(ESMO)에 이어 아시아(Pan-Asian ESMO) 진료지침에서도 절제불가 3기 비소세포폐암 치료를 위한 표준요법으로 임핀지 사용 권고
국내 출시된 면역항암제 최초로 ‘관해공고요법’으로 건강보험 급여 적용, 완치를 목적으로 하는 폐암 치료 시대 열어
한국아스트라제네카는 6월 10일 ‘가이드라인과 급여기준을 모두 바꾼 임핀지’를 주제로 온라인 기자간담회를 개최하고, 최근 업데이트 된 범 아시아(Pan-Asia) ESMO 가이드라인과 PACIFIC 임상 3상 연구의 하위분석 결과를 소개했다.
임핀지(성분명 더발루맙)는 절제불가 3기 비소세포폐암 치료옵션 가운데 20년만에 유의미한 생존개선을 입증한 PACIFIC 3상 임상연구 결과를 바탕으로, 미국(NCCN)과 유럽(ESMO) 가이드라인에 이어[i] 아시아 환자를 위한(Pan-Asia ESMO) 진료지침에서 표준요법으로 권고되고 있다.
또한, 지난 4월 1일부터 국내 출시된 면역항암제 중 유일하게 비소세포폐암의 ‘관해공고요법’으로 건강보험을 적용 받으면서 완치(cure)를 목적으로 하는 폐암 치료 시대를 열었다.
이날 간담회에서는 범 아시아(Pan-Asia) ESMO 가이드라인의 집필위원장을 맡은 삼성서울병원 혈액종양내과 박근칠 교수가 첫 번째 연자로 나서, 지난 20여년간 절제불가 3기 비소세포폐암 치료 영역에서 지적돼 온 임상적 미충족 수요 및 PACIFIC 연구 결과로 인한 국제 진료지침의 변화에 대해 발표했다.
박근칠 교수는 “3기 폐암은 국소적으로 진행된 상태이나 완치를 목적으로 수술 혹은 방사선 요법과 더불어 항암 화학요법 등을 병용하여 치료를 시행하게 된다. 하지만 지난 30여년간 여러 연구에도 불구하고 근치적 절제가 불가능한 3기 환자의 경우 5년 생존율이 20%를 밑도는 등 예후가 좋지 않았다[ii]”며 “PACIFIC 연구는 3기 폐암의 완치 가능성을 높이고, 지난 20여년간 제자리에 머물었던 치료 패러다임에 전환점을 가져왔다는 점에서 의미가 크다”고 설명했다.
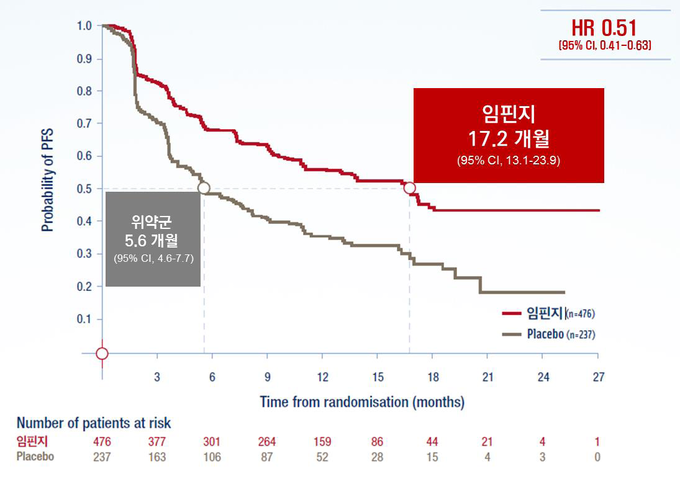
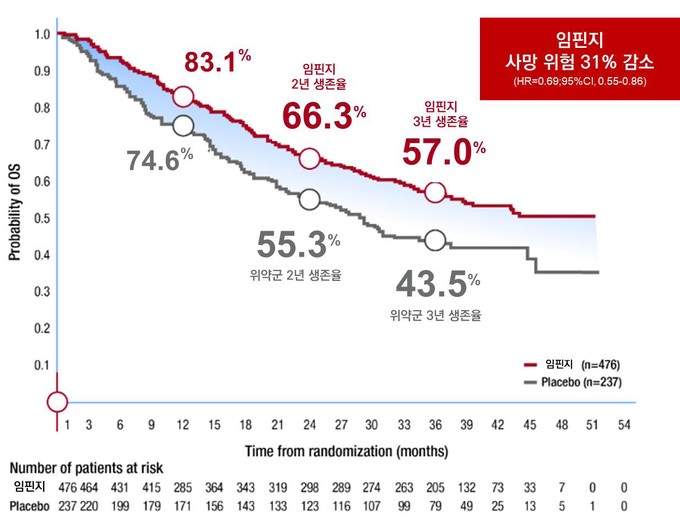
PACIFIC 연구는 절제불가 3기 비소세포폐암 환자들을 대상으로 임핀지의 무진행생존기간 및 전체생존율 개선 효과를 평가한 3상 임상시험으로, 임핀지 치료군의 무진행생존기간 중앙값(mPFS)은 위약군 5.6개월(95% CI, 4.6-7.7) 대비 11.6개월 향상된 17.2개월(95% CI, 13.1-23.9)로 나타났다(Stratified HR=0.51, 95% CI, 0.41-0.63 / Data cut off: March 22, 2018). 3년 시점에서 확인된 임핀지 치료군의 전체생존율(OS rate)은 57%로(vs. 위약 군 43.5%), 여전히 절반 이상의 환자들이 생존하고 있는 것으로 나타났다.[Data cutoff: January 31, 2019] 임핀지 투약 시 위약 군 대비 가장 흔하게 발생(20% 이상 환자에서 발생)한 이상사례는 기침(35.2% vs. 25.2%), 피로(24.0% vs. 20.5%), 호흡 곤란(22.3% vs. 23.9%), 방사선 폐렴(20.2% vs. 15.8%) 등이었다.
이에 따라, 미국(NCCN)과 유럽(ESMO)의 진료지침 개정에 이어, 올 1월에 발표된 범 아시아(Pan-Asia) ESMO 가이드라인에서도 집필위원들은 만장일치로 동시적 항암화학방사선요법(CCRT) 이후 42일 이내 임핀지 투여를 단독 표준요법으로 권고했다(A-I-A 등급).
PACIFIC 연구 결과 및 국제 진료지침 권고사항을 바탕으로, 국내에서도 지난 4월 1일부터 임핀지에 대해 ‘PD-L1 발현율 1% 이상의 환자에서 관해공고요법’으로 건강보험 급여가 적용되고 있다. 급여 인정 기간은 투약 시작일로부터 최대 1년까지로, 임핀지 투약 완료 후 6개월 간 질병의 진행이 나타나지 않은 환자가 재발할 경우 고식적요법으로 타 면역항암제 치료가 가능하다.
두 번째 발표를 맡은 한국아스트라제네카 의학부 임재윤 이사는 “PACIFIC 연구에서 임핀지는 사전 정의된 모든 하위 그룹(prespecified subgroup)에서 일관된 생존 개선 효과를 나타냈고, PD-L1 발현 양성 (1% 이상)에서 보다 더 향상된 생존 연장 효과를 나타냈다”며 “이번 임핀지 급여 등재를 계기로 국내 면역항암제의 사용 목적을 관해공고요법과 고식적요법으로 구분하는 계기가 되었으며, 임핀지 치료가 완화(palliative-intent)가 아닌 완치(curative-intent) 목적임을 나타낸다”며 고 설명했다.
PACIFIC 연구에 참여한 환자들을 연령, 흡연 여부, PD-L1 발현(25% 이상 또는 미만), EGFR 변이 상태 등 다양한 하위 그룹으로 분석한 결과, 10개 그룹 모두에서 임핀지 치료군은 위약군에 생존율 개선에 우호적인 경향을 보였다. 이후 진행된 PACIFIC 연구의 사후분석(Post-hoc)에서, 전체 환자 대비 PD-L1 발현율 1% 이상일 경우, PFS HR가 0.52에서 0.46으로 더 감소하여 질병의 진행 및 사망의 가능성을 낮추는 효과가 더욱 뚜렷한 것으로 확인됐다.
한국아스트라제네카 항암제사업부 김수연 전무는 “임핀지는 전세계적으로 표준요법으로 권고되고 있는 절제불가 3기 비소세포폐암 치료를 위한 최선이자 최적의 치료 옵션” 이라며 “그동안 치료 대안이 마땅치 않았던 3기 환자들이 보다 적극적인 치료를 받을 수 있는 환경이 마련되어 기쁘게 생각하고, 앞으로 더 많은 환자들의 치료 접근성을 높이기 위한 노력을 지속해 갈 것”이라고 밝혔다.
PACIFIC 연구에 대하여
PACIFIC 임상연구는 백금기반 항암화학 방사선 요법 이후 PD-L1 발현율에 관계없이 질병이 진행되지 않은 모든 절제불가능한 3기 비소세포폐암 환자에서 임핀지의 사용에 대한 무작위, 이중맹검, 위약대조, 다기관 3상연구다.
본 연구는 26개국, 235개 기관 713명을 대상으로 실시되었다. PACIFIC 연구의 두가지 1차 유효성평가 기준은 무진행생존기간(PFS)과 전체생존기간(OS) 이고, 2차 유효성평가기준은 2차 무진행생존기간(landmark PFS), 24개월 시점의 전체생존율(OS rate), 객관적반응률(ORR, overall response rate), 그리고 치료반응기간(duration of response)이다.
3기 비소세포폐암에 대하여
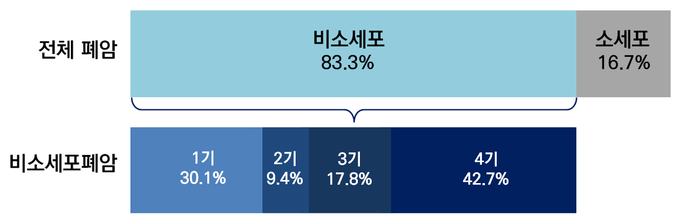
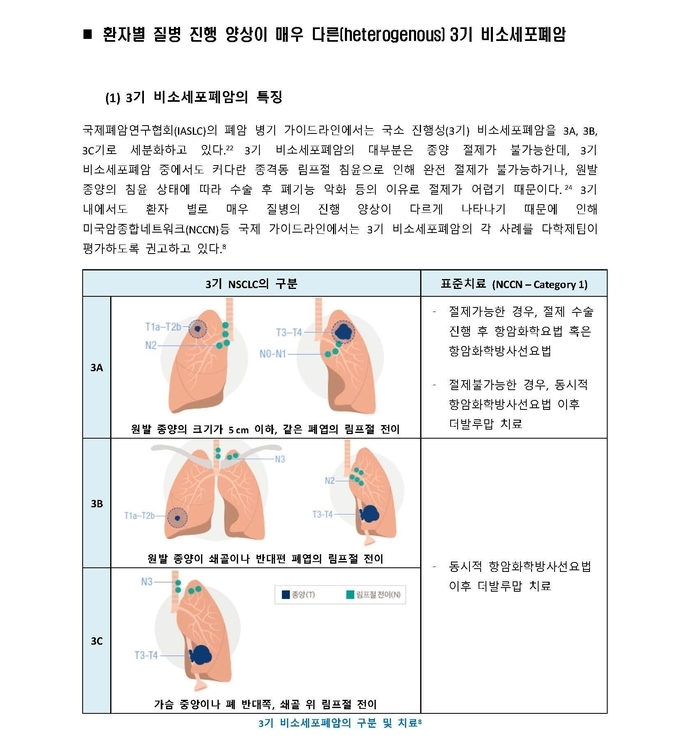
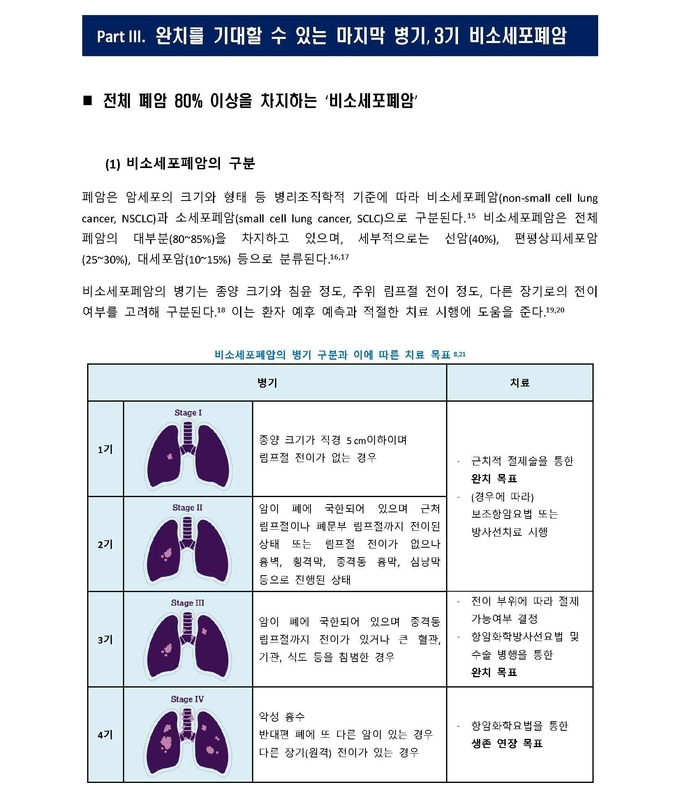
국소진행성(3기) 비소세포폐암은 일반적으로 세가지(IIIA, IIIB 및 IIIC)로 나뉘며, 이는 암의 국소적분포정도 및 수술가능 여부에 따라 결정된다. 암이 원격장기에 퍼져있는 4기와는 차이가 있으며, 3기 비소세포폐암의 치료는 완치를 목적(curative intent)으로 한다.
3기 비소세포폐암은 전체 비소세포폐암 발생의 1/3 정도에 해당되며 2015년 기준 상위 8개국(중국, 프랑스, 독일, 이탈리아, 일본, 스페인, 영국, 미국) 환자수는 20만명으로 추정된다. 3기 비소세포폐암 환자의 대부분은 진단시 이미 수술이 불가능하다고 판정받는다. 현재 항암화학방사선요법(chemoradiation) 이후 적극적인 추적관찰을 통한 질환진행 여부를 모니터링하는 표준치료요법 이상의 치료법이 수십년간 제시되지 않은 상황이다.
임핀지™에 대하여
임핀지(더발루맙)는 PD-L1과 결합해 PD-L1이 PD-1 및 CD80과 상호작용하는 것을 차단, 종양의 면역회피 기전을 저해하고 면역반응의 억제를 완화하는 인간단일클론항체다.
임핀지는 3상 임상 PACIFIC 결과를 바탕으로 항암화학 방사선 요법으로 치료받은 절제불가능한 3기 비소세포폐암 환자의 치료제로 미국과 유럽, 일본 등을포 함해 62개국에서 허가를 받았다. 한국에서 임핀지는 백금기반 동시적 항암화학 방사선 요법이후 질병이 진행되지 않은 절제불가능한 국소진행성 비소세포폐암 환자의 치료에 허가되었다.
연구개발 프로그램의 일환으로 임핀지는 비소세포폐암, 소세포폐암, 방광암, 두경부암, 간암, 자궁경부암, 담도암 등 다양한 암종에서 단독요법 혹은 트레멜리무맙, 항CTLA4 단일클론항제, 신약후보물질 등과의 병용요법 등으로 다양하게 연구되고 있다.
아스트라제네카의 면역항암제 분야 전략에 대하여
면역항암제는 신체의 면역체계를 자극해 종양을 공격하도록 고안된 치료접근방식이다. 아스트라제네카는 면역항암제 포트폴리오의 기반을 항종양면역억제를 극복하도록 고안된 요법에 두고있다. 아스트라제네카는 면역항암제 기반 요법이 환자대다수에게 삶을 바꿀 수 있는 암치료의 가능성을 제공할 것으로 보고있다.
이외에도, 면역항암제를 아스트라제네카의 항암제 파이프라인 및 연구파트너의 다양한 저분자, 표적분자 파이프라인과 결합해 다양한 암종에서 새로운 치료옵션을 제공하고자 노력하고 있다.
아스트라제네카(AstraZeneca)의 항암사업에 대하여
아스트라제네카는 항암연구에 뿌리깊은 전통을 가진 회사로서, 환자들의 삶과 기업의 미래를 변화시킬 수 있는 잠재력을 가진 다양한 약물들을 개발하고 있다. 2014년에서 2020년 사이에 적어도 여섯가지의 신약출시와 분자학과 생물학의 폭넓은 파이프라인을 개척을 통해 폐암, 난소암, 유방암 및 혈액암을 중심으로 항암연구를 진행하며, 항암부문을 아스트라제네카의 성장동력으로 삼고있다. 뿐만 아니라, 혈액암연구에서 AcertaPharma와 협력했던 것처럼, 아스트라제네카는 전략전달을 가속화하는 혁신적인 파트너십과 투자를 적극적으로 추구할 것이다.
아스트라제네카는 면역항암, 암의 유전적 요인과 내성, DNA 손상복구 및 항체-약물결합체의 네가지 과학적 플랫폼을 원동력으로 삼고 개별화된 복합치료의 개발에 중점을 두어, 항암치료의 새로운 지평을 열고 가까운 미래에 암으로 인한 사망을 뿌리뽑는 것을 비전으로 한다.
아스트라제네카에 대하여
아스트라제네카는 세가지 주요 질환의 치료분야인 종양, 심혈관질환, 신장-대사 및 호흡기분야의 전문의약품연구, 개발 및 공급에 주력하고 있는 과학주도 글로벌바이오제약회사다. 아스트라제네카는 자가면역질환, 신경과학질환 및 전염병 등의 분야에서도 선별적으로 활발히 활동하고 있다. 현재 100개국 이상에 지사를 운영하고 있으며, 세계 수백만명 이상의 환자들이 아스트라제네카의 혁신의약품을 사용중이다.
더 자세한 정보는 홈페이지www.astrazeneca.com 및 트위터계정 @AstraZeneca에서 확인할 수 있다.
References
1 NCCN Guidelines for NSCLC Version1. 2019 – October 19, 2018
2 ESMO Guideline
3 보건복지부고시제2020-61호및건강보험심사평가원공고제2020-81호
4 Albain KS, et al. Lancet. 2009; 374(9687): 379–386.
5 Antonia, S. J., Villegas, A., Daniel, D., Vicente, D., Murakami, S., Hui, R., ... & Cho, B. C. (2018). Overall survival with durvalumab after chemoradiotherapy in stage III NSCLC. New England Journal of Medicine, 379(24), 2342-2350.
6 Gray JE, et al; Three-year overall survival with durvalumab after chemoradiotherapy in Stage III NSCLC - Update from PACIFIC, Journal of Thoracic Oncology 2020:15(2):288-293.
8 Park, K. et al. Annals of Oncology. 2020;31(2):191-201.
9 보건복지부고시제2020-61호및건강보험심사평가원공고제2020-81호
10 S Antonia SJ, et al. NEJM 2017;377(20):1919-1929.
11 Antonia, S. J., Villegas, A., Daniel, D., Vicente, D., Murakami, S., Hui, R., ... & Cho, B. C. (2018). Overall survival with durvalumab after chemoradiotherapy in stage III NSCLC. New England Journal of Medicine, 379(24), 2342-2350.
12 Antonia SJ, Villegas A, Daniel D, et al. Overall survival with durvalumab after chemoradiotherapy in stage III NSCLC [article and supplementary appendix]. N Engl J Med. 2018;379:2342-2350.
13 AstraZeneca PLC Press Release. December 12, 2019