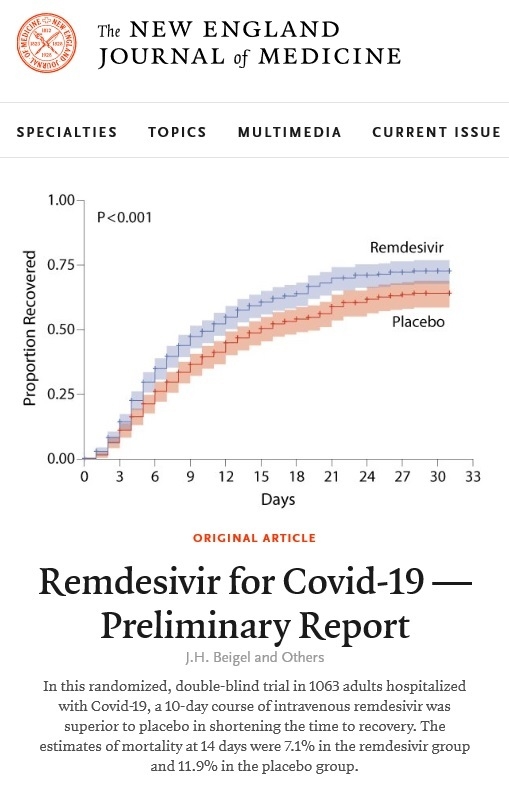
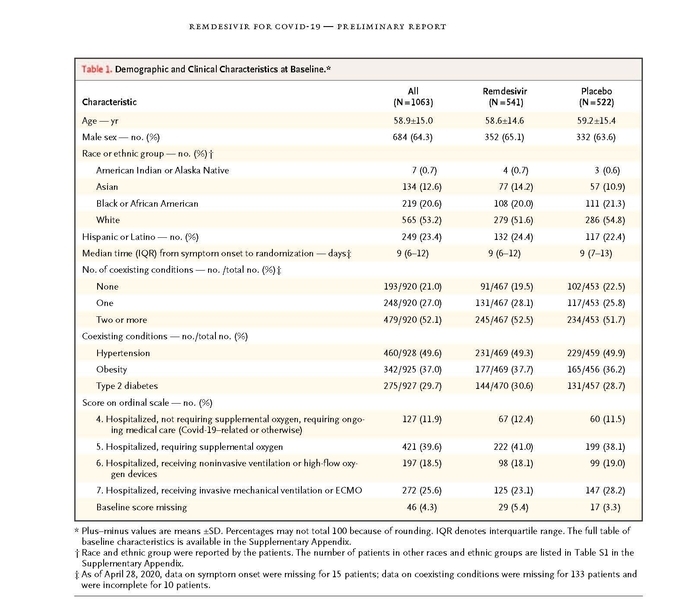
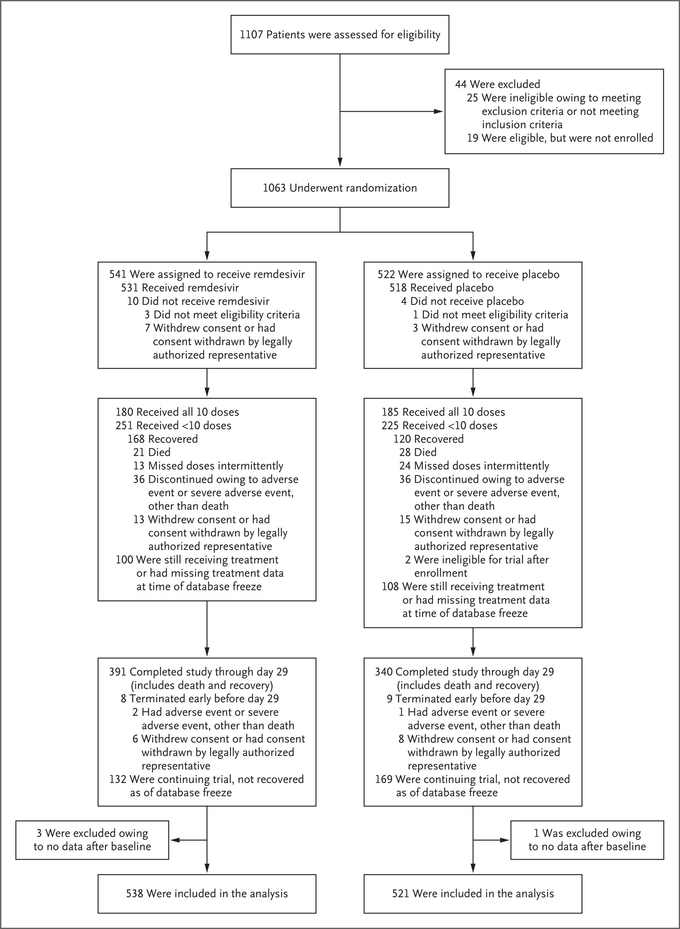
이 임상시험은COVID-19 폐렴 환자 1063명을 대상으로 렘데시비어 또는 위약을 10일간 투여하였는데, 위약군에 견주어 렘데시비어 치료군에서 회복시간이 31% (15일→ 11일) 단축되었다.
이 결과를 근거로 5월 1일에 미국 FDA(식약처)는 렘데시비어를 「중증」환자(산소포화도 <94%, 산소 치료 필요)에게 긴급사용허가를 승인하였다.
이연구는 전세계 10개국, 73개 의료기관이 참여한 다국가, 다기관 임상 시험이다.
미국에서 45개 의료기관이, 유럽과 아시아에서 28개 의료기관이 참여하였는데, 아시아에서는 한국, 일본, 싱가포르가 참여하였다. 이렇게 많은 기관이 공동 연구를 진행하였기에 2월 21일에 환자등록을 개시한 지 2달만에 1000명이 넘는 많은 환자를 모집할 수 있었고, 임상시험의 gold standard라고 하는(가장 수준이 높은)이중맹검, 위약 대조연구 디자인으로 렘데시비어의 효능을 평가할 수 있었다.
사실, 중국에서 먼저 이 연구와 비슷한 임상 시험이 수행되었다. 중국의 렘데시비어 임상 시험은 후베이성의 10개 의료기관이 참여하였는데, 중국의 환자수가 급격히 감소하면서 목표 환자수의 절반 정도인 237명을 모집하는데 그치고 말아, 렘데스비어의 효과를 제대로 평가하지 못하였다.
또 다른, 렘데시비어의 제조회사인 길리어드사가 지원하는 임상시험도 비슷한 시기에 진행되었다.
이 임상시험의 디자인은 위약군을 두지 않고, 5일치료군을 10일 치료군과 비교하는 임상시험이였다. 이 시험 결과, 렘데시비어 5일 치료군과 10일 투여군의 치료 효과나 부작용이 서로 비슷한 것으로 나왔다. 그러나 위약 대조군이 없기때문에 그 효과가 위약보다 더 좋은지는 알 수 없다는 한계를 가진 연구이다.
미국 NIH의 연구는 위 두 연구의 한계를 모두 극복하여, 렘데시비어의 치료 효과를 확실하게 평가할 수 있었다는 점에서 매우 중요하다. 특히 국가 연구기관이기에 치료 효과가 어느 쪽(없다고 나올 수도 있는데..)으로 나오는지에 상관없이 확실한 결론을 얻을 수 있는 이중맹검, 위약 대조 디자인으로 임상시험을 추진할 수 있었다. 이는 왜 공공기관이 임상 연구를 수행해야 하는지를 웅변하는 사례라고 하겠다. 우리 나라도 이러한 임상 연구를 수행할 수 있는 국가 시스템을 갖추는 일이 시급하다.
또한, 이 연구가 진행되던 기간 동안은 미국에서 코로나-19 유행 곡선이 매우 가파르게 올라가던 시기였고, 연구에 참여한 많은 의료기관에서는 몰려드는 환자를 돌보느라 연구에 할애할 시간이 부족하고, 검체 채취 기구가 동이 나거나, 의료인들이 개인 보호구를 제대로 공급받지 못하는 매우 어려운 상황에 처해 있었다. 이렇게 어려운 여건하에서도 임상시험을 수행하여 렘데시비어가 환자의 회복에 도움이 된다는 확실한 결과를 얻었다는 것은 높이 평가해야할 업적이다.
이 연구에서 2차 평가 지표는 치사율인데, 치료 후 14일의 치사율은 11.9%에서 7.1%로 줄었다.만일에 치사율이 35% 감소되는 결과를 증명하려면(예, 치사율 10% 6.5%, 통계 power 85%, type 1 error 5%), 사망에 도달한 수가 최소 200명이 필요하고, 따라서 2,000여명의 시험 참가자를 모집해야 한다. 그러나, 환자 2,000명을 임상시험에 모집하는 일은 현재 판데믹 상황에서 불가능하다고 판단하였기 때문에, 애초 연구 디자인 단계부터 치사율 감소는차 평가항목에 포함되지 않은 것이다.
대신에 환자 상태가 회복되는 것을 치료의차 평가 항목으로 설정하였다.
이 연구에서 환자의 상태는 (1) 입원하지 않음, 활동 지장 없음, (2)입원하지 않음, 활동 지장 있음 +/- 집에서 산소 필요, (3) 입원함, 산소필요 없음 + 진료 필요 없음(격리가 필요해서 입원중인 사례), (4) 입원함, 산소치료 필요없음+진료 필요함 (COVID-19 관련 또는 다른 의학적 상황으로), (5) 입원함, 산소 치료가 필요함, (6)입원함, 비침습 호흡, high flow O2 devices, (7) 입원함, 기계호흡, ECMO, (8) 사망으로 구분하였다. 여기에서 임상시험에 참여하는 기준은 (5), (6), (7)상태에 있는 환자이며, 렘베시비어 치료 개시후 (1), (2), (3)에 도달하면 회복으로 정의하였다.
따라서 회복된 환자는 퇴원이 가능하거나 입원해 있더라도 산소치료가 필요없는 상태다. 이런 회복이 15일11일로 4일간 단축되었다는 것은 인공호흡기나 중환자실, 산소와 같은 의료 자원이 그 만큼 더 많아지는 효과가 있으므로, 의료 시설과 기구가 절실히 필요한 판데믹 상황에서는 매우 의미있는 효과라고 하겠다.
이번 NIH 주도 임상연구를 통해서 렘데시비어는 최초의 코로나-19 치료제로 인정받게 되었다. 이제치료제임상시험에서위약을쓰는것은윤리적으로허용할수없게 되어서, 앞으로 개발되는 코로나-19 치료제는 렘데시비어보다 더 월등하거나, 최소한 열등하지 않다는 것을 증명해야 하는 상황이 되었다.
이제 렘데시비어가 코로나-19의 표준 치료제가 된 것이다.
렘데시비어의 치료 효과는 아직도 개선의 여지가 남아 있다. 항HIV치료제 개발의 역사에서도 첫 치료제가 나온 이후에는 그 약물을 꾸준히 개선하여 강력하고 안전한 많은 치료제가 개발되었다. 그러므로 이번 렘데시비어 임상 시험은 proof of concept를 제공하였고, 앞으로 이 약이 타깃으로 하는 RNA-dependent RNA polymerase를 더 잘 억제하는 제 2세대, 제 3세대 약물이 나올 것으로 기대한다. 또한 바이러스 증식 과정의 다른 부위를 타깃으로 하는 항바이러스제와 인체의 면역기능을 조절하는 약제들도 앞으로 개발될 것으로 기대한다.