나노입자 덩어리로 암세포 죽여!
기존 항암치료는 암세포 뿐 아니라 정상세포도 공격한다. 때문에 암세포만 골라 제거하기 위한 연구가 활발하다. 기초과학연구원(IBS, 원장 노도영) 첨단연성물질 연구단(단장 스티브 그래닉) 바르토슈 그쥐보프스키 그룹리더와 연구진은 전하를 띠는 리간드1)를 부착한 금속 나노입자를 이용해 암세포를 선택적으로 파괴하는 데 성공했다.
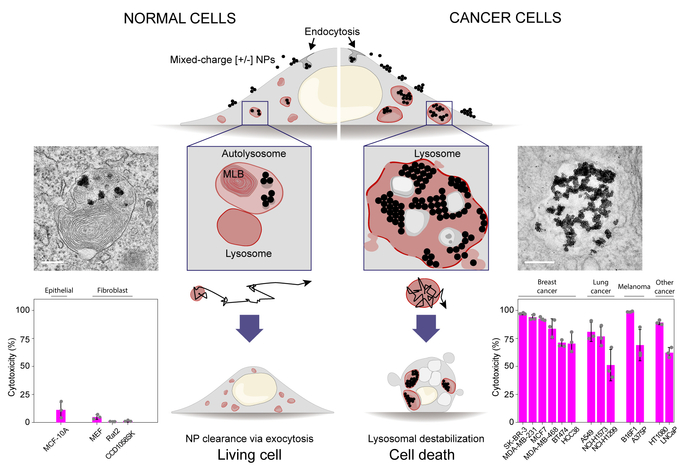
나노입자는 정상세포와 암세포가 공통으로 갖는 ‘리소좀(Lysosome)2) 내부로 침투하는데, 이 나노입자는 암세포 내에서만 덩어리를 이뤄 리소좀을 망가뜨리고 세포를 죽이는 원리다.
리소좀은 세포 내에서 ‘재활용 쓰레기통’ 역할을 하는 주머니 형태의 기관이다. 세포에서 못 쓰게 된 다른 기관을 분해해 다시 단백질로 만들거나, 바이러스와 같은 외부 물질을 파괴하는 활동도 모두 여기서 일어난다. 이 리소좀 주머니의 벽이 파괴되면 안에 있던 ‘쓰레기’들이 새어나오면서 세포가 죽는다. 이 현상을 암세포에서만 나타나게 하는 항암제 연구가 시도됐으나, 아직은 정상적인 세포에도 영향을 주는 문제가 있었다.
연구진은 암세포 주변이 산성이라는 점에 착안해, 산성 환경에서 결정화 현상이 달라지는 나노입자를 설계했다. 암세포에서만 결정이 커지는 나노입자가 있다면 암세포 속 리소좀을 파괴하고 세포 사멸까지 이끌 수 있다고 본 것이다.
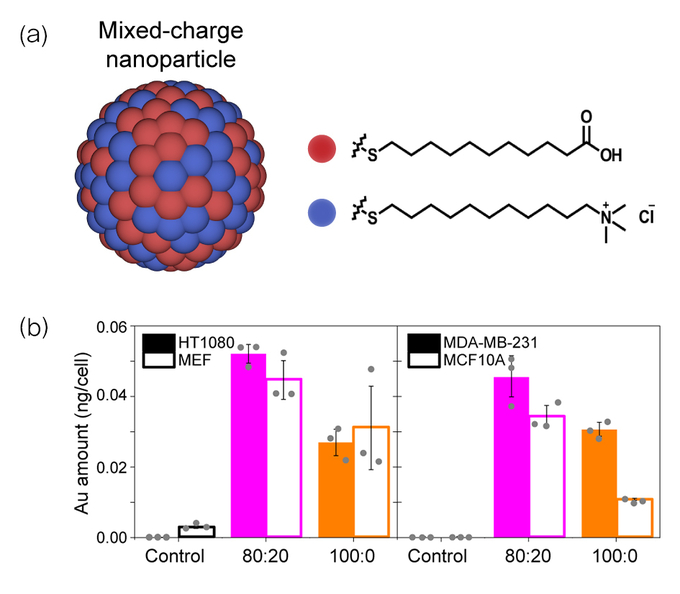
연구진은 금 나노입자 표면에 양전하와 음전하를 각각 띠는 꼬리 모양 분자인 리간드를 특정 비율로 붙였다. 설계한 나노입자는 산성에서 결정이 점점 더 커지는 특성을 가져, 정상세포와 암세포에 주입하자 암세포만 선택적으로 사멸됐다.
공동교신저자인 크리스티아나 칸델-그쥐보프스카 연구위원은 “암세포는 산성을 띠므로 나노입자가 잘 뭉치고, 암세포는 그 기능이 비정상적이라 큰 결정으로 자란 나노입자를 배출하기 힘들어 결국 사멸한다”며 “암세포 선택성을 극대화하려면 나노입자가 리조좀으로 잘 운반돼야 하는데, 나노입자 표면의 양이온과 음이온 비가 8:2일 때 덩어리 크기가 적당해 잘 운반됐고 사멸 효과도 높았다”고 설명했다.
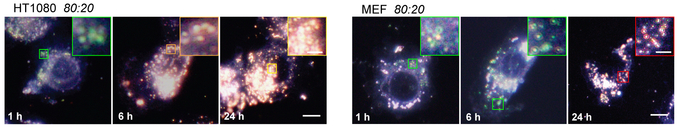
세포 내 나노입자의 움직임은 암시야현미경3)을 통해서도 입증됐다.
현미경 분석을 주도한 조윤경 그룹리더는 “나노입자는 크기가 단백질 분자 수준으로 작아 관찰이 까다로운 연구”라며 “관찰을 위한 꼬리표를 붙이면 양이온과 음이온의 황금비율인 8:2를 해칠 우려가 있어 특수한 관찰법이 필요했다”고 말했다.
연구진은 또 거대한 나노입자 결정을 품은 암세포의 리소좀 내부에서 세포 성장을 담당하는 신호 단백질(mTORC1)의 작용이 억제되는 현상을 발견했다. 이 단백질은 정상세포에서 더 활성화된다. 따라서 해당 단백질이 리소좀 벽의 파괴와 암세포 사멸에 영향을 줬다고 추측할 수 있었다.
바르토슈 그쥐보프스키 그룹리더는 “고장난 암세포의 특징 즉, 세포 주변이 산성이고 이물질 배출도 어렵다는 점을 역으로 활용해 암세포를 죽일 수 있다는 점에서 흥미롭다”며, “앞으로 동물실험을 진행해 항암치료제로서 가능성을 추가로 살필 것”이라고 연구계획을 밝히며 “나노입자에 리간드를 붙여 선택적으로 입자의 뭉침을 유도하는 방법은 금속 나노입자뿐 아니라 고분자 나노입자 등에도 적용할 수 있다”며 “이번 연구는 나노입자 과학의 관점에서도 큰 의의가 있다”고 전했다.
이번 연구는 세계적인 과학 학술지 네이처 나노테크놀로지(Nature Nanotechnology, IF 33.407) 誌에 3월 16일 게재됐다.
논문명 : Targeted crystallization of mixed-charge nanoparticles in lysosomes induces selective death of cancer cells
1) 리간드(Ligand) : 중심 금속원자를 둘러싸고 있는 분자나 이온. 이번 연구에서는 양전하와 음전하를 각각 띠는 긴 분자를 사용했다.
2) 리소좀(Lysosome) : 단백질 분해효소가 들어있는 세포 내의 작은 주머니이다. 일반적으로 오래되어서 못 쓰게 된 세포소기관을 파괴하거나 외부에서 탐식 작용을 통해 먹어 치운 바이러스나 박테리아 같은 외부 물질들을 파괴하는 데에 사용된다.
3) 암시야현미경(Dark field microscopy) : 광선을 옆으로 전환하게 만들고, 대상물을 옆에서 조명해 어두운 배경에 대해서 미세구조가 환하게 비치도록 한 현미경이다. 살아 있는 상태의 미생물을 효과적으로 관찰할 수 있다.
용어 설명
1. 리소좀(Lysosome)
세포소기관 중 하나로 작은 주머니 형태를 띠고 있다. 안에는 단백질 분해효소가 있어 일반적으로 못 쓰게 된 세포소기관을 파괴해 단백질을 재생산하거나, 외부에서 탐식작용을 통해 먹어 치운 바이러스나 박테리아 같은 외부 물질들을 파괴하는 역할을 한다. 세포 내 리소좀으로 나노입자가 들어가기 위해서는 세포막으로 나노입자가 들어오는 직접침투가 아닌 세포 내 섭취작용(endocytosis)이 잘 일어나야 한다. 이번 연구에서는 나노입자 표면에 양이온과 음이온을 8:2로 흡착하는 것은 이러한 세포 내 섭취작용이 잘 일어나게 하는 역할을 한다.
2. 세포소기관(Cell Organells)
인체에 여러 가지 기관이 존재하는 것처럼 진핵세포의 내부에 존재하며 세포의 여러 가지 기능을 분업으로 하고있는 구조단위. 대표적인 예로 리소좀, 미토콘드리아, 골지체 등이 있다.
3. 리간드(Ligand)
배위결합을 통해 중심 원자를 둘러싸고 있는 이온 또는 분자를 이른다. 이번 실험에는 금나노 입자에 양전하를 띠는 리간드와 음전하를 띄는 리간드를 8:2로 섞어 결합했다.
4. 암시야현미경(Dark Field Microscopy)
광선을 옆으로 전환하게 만들고, 대상물을 옆에서 조명해 어두운 배경에 대해서 미세구조가 환하게 비치도록 한 현미경이다. 살아 있는 상태의 미생물을 효과적으로 관찰할 수 있다.
5. mTORC1(Mammalian Target of Rapamycin Complex1)
세포 성장, 세포 생존, 단백질 합성, 유전자 발현 등 세포 내 다양한 생리 현상을 조절하는 중요인자로 최근에는 수명 연장과 밀접한 관련이 있다는 것이 밝혀져 있고, 성장인자와 아미노산 농도에 따라 활성이 조절되는 인산화 효소로 알려져 있다.
그림 설명
정상세포와 달리 암세포에서는 금속 나노입자 지속적으로 뭉쳐져 성장하는 현상이 나타나 세포가 죽게 된다. 13종류의 암세포(우측 하단 막대 그래프)에 실험을 진행했으며, 암세포의 종류에 관계없이 금속나노입자 덩어리가 세포 사멸을 유도한다.
암세포(왼쪽)에서는 정상세포(오른쪽)과 달리 시간이 지나면서 입자의 뭉침이 나타났다.
(a) 금나노 입자 표면에 양이온(파란색)과 음이온(붉은색) 리간드가 부착된 모습 (b) 양이온과 음이온의 비율을 8:2로 유지(분홍색)했을 때 양이온만 결합한 경우(주황색)에 비해 세포 내 나노입자의 함량이 더 높았다.
연구진 이력사항
[바르토슈 그쥐보프스키 그룹리더, 공동교신저자]
1. 인적사항
· 소 속 : 기초과학연구원(IBS) 첨단연성물질 연구단
울산과학기술원(UNIST) 자연과학부 특훈교수
· 전 화 : 052-217-5522
· 이메일: nanogrzybowski@gmail.com
2. 학력
1995 학사, 미국 예일 대학교
2000 박사, 미국 하버드 대학교
3. 경력사항
2003 – 2014 미국 노스웨스턴 대학교 (Northwestern University) 교수
2009 – 2014 미국 노스웨스턴 대학교 비균형 에너지 연구센터 총괄
2014 – 현재 기초과학연구원(IBS) 첨단연성물질 연구단 그룹리더
울산과학기술원(UNIST) 자연과학부 특훈교수
** 인공지능 화학 합성 프로그램 ‘케마티카(Chematica)’개발(2012)
(컴퓨터 스스로 화학적 합성 모델을 만들고 계획을 세우는 소프트웨어)
4. 전문 분야 정보
2006 미국화학회 콜라이드와 표면화학 유니레버 어워드 수상
2007 슬로안(Sloan) 펠로십 선정
2007 영국 왕립학회 연성물질 어워드(Soft Matter Award) 수상
2013 국제나노과학회(International Society for Nanoscale Science) 나노과학상(Nanoscience Prize) 수상
2015 영국 왕립학회(Royal Society of Chemistry) 화학분야 펠로 선정
2016 미국 포어사이트 연구소 파인만 상(Feynman Prize in Nanotechnology) 수상
[크리스티아나 칸델-그쥐보프스카 연구위원, 공동교신저자
1. 인적사항
· 소 속 : 기초과학연구원(IBS) 첨단연성물질 연구단
울산과학기술원(UNIST) 생명과학부 겸임교수
· 전 화 : 052-217-5516
· 이메일: kristiana.kandere@gmail.com
2. 학력
1998 학사, 미국 세인트 로즈 대학교
** 최우등졸업 (숨마쿰라우데)
2003 박사, 미국 터프츠 대학교
3. 경력사항
2003 – 2006 미국 노스웨스턴 대학교 박사후연구원
2006 – 2014 미국 노스웨스턴 대학교 연구조교수
2015 – 현재 기초과학연구원(IBS) 첨단연성물질 연구단 연구위원
울산과학기술원(UNIST) 생명과학부 겸임교수