· BRAF V600E 변이가 확인된 비소세포폐암에 대한 새로운 치료옵션 제시
· 임상결과, 환자의 64%가 질병 조절을 경험한 것으로 나타나
한국노바티스(대표 조쉬 베누고팔)는 자사의 BRAF V600 E 변이 양성 전이성 비소세포폐암 표적치료제 ‘라핀나 (성분명: 다브라페닙메실산염, dabrafenib)’와 ‘매큐셀 (트라메티닙디메틸설폭시드, trametinib)’ 병용요법에 대해 2월 10일부터 BRAF V600E 변이가 확인된 전이성 비소세포폐암 환자의 1차 치료 이상의 조건으로 건강보험 급여가 적용된다고 밝혔다.[i]
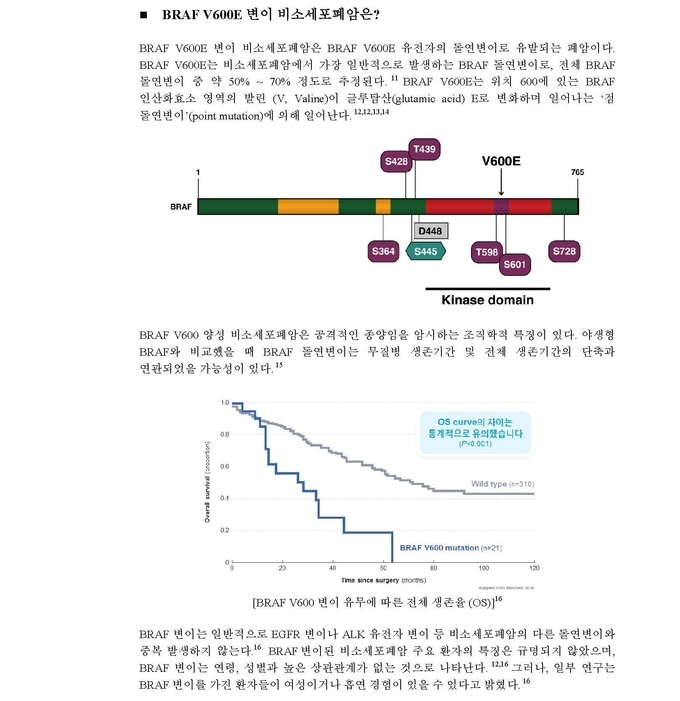
BRAF V600 변이 양성 전이성 비소세포폐암은 전 세계 비소세포폐암의 약 1~3%를 차지한다.[ii],[iii] 전체 BRAF 돌연변이 중 약 50% ~ 70% 정도로 추정되고2 연령이나 성별과 높은 상관관계가 없는 것으로 분석된다.3,[iv] BRAF 변이를 가진 환자는 BRAF 정상형 환자와 비교해 무병 생존 및 전체 생존기간이 짧고, 환자의 예후가 좋지 않아4 새로운 치료옵션이 절실한 상황이었다.
라핀라 매큐셀 병용요법은 2월 10일 발표된 건강보험심사평가원 공고 제 2020-28호에 따라 BRAF V600E 변이 비소세포폐암 환자에게 보험급여를 통해 치료 혜택을 제공할 수 있게 되었다. 급여 투여 조건은 BRAF V600E 변이가 확인된 전이성 비소세포폐암 환자 대상이며 1차 치료 이상인 경우 가능하다.1
이번 급여 승인은 BRAF V600E 변이 양성 비소세포폐암 환자를 대상으로 한 글로벌2상 임상연구 결과를 근거로 이뤄졌다. 연구에 참여한 환자들은 3개의 환자군(Cohort)으로 분류됐으며 라핀나 단독요법 치료군(Cohort A)과 라핀나 매큐셀 병용요법 군으로 구분됐다.[v], [vi]
라핀나 매큐셀 병용요법 그룹에는 항암 치료를 받은 경험이 있는 환자 57명(Cohort B)과 치료 경험이 없는 환자 36명(Cohort C)로 나뉘었다. 각 환자군에 라핀나(150mg, 1일 2회)와 매큐셀(2mg, 1일 1회)을 매일 병용 투여한 결과, 항암 치료 경험이 없는 환자군에 더 유의미한 임상결과를 보였다. 객관적 반응률[1]이 64%로 전체 환자 36명 중 23명이 병용요법에 반응을 보였으며(95% 신뢰구간[CI]: 46–79), 반응지속기간[2] 중앙값은 10.4개월이었다. (95% 신뢰구간[CI] 8·3–17·9) 무진행생존기간[3] 중앙값은 10.9개월 (95% 신뢰구간[CI]: 7·0–16·6), 전체 생존기간[4] 중앙값은 24.6개월을 보였다. (95% CI 12·3–비 추정)[vii]
한국노바티스 항암제사업부 신수희 총괄은 “라핀나 매큐셀 병용요법은 BRAF V600E 변이가 확인된 전이성 비소세포폐암 치료에 대한 승인을 받은 최초의 병용요법이자 유일한 표적치료제” 라며 “BRAF V600E 양성 전이성 비소세포폐암의 경우 기존 화학치료요법으로는 예후가 좋지 않아 새로운 치료 옵션이 절실한 상황이였다. 이번 급여 결정으로 라핀나 매큐셀 병용요법이 BRAF V600E 변이된 환자들에게 새로운 치료 옵션을 제공할 수 있을 것으로 기대된다” 고 밝혔다.
[라핀나 매큐셀 병용요법에 대하여]
2019년 국내에 출시된 ‘라핀나 매큐셀’ 병용요법은 BRAF V600E변이가 확인된 수술이 불가능하거나 전이성인 흑색종 환자의 1차 이상 치료에 대해 2017년 11월 1일부터 건강보험급여를 적용 받고 있다. 이전에 BRAF 억제제 혹은 MEK 억제제를 사용한 경우는 건강보험급여 대상에서 제외된다.8
BRAF 억제제 라핀나와 MEK 억제제 매큐셀을 병용하는 ‘라핀나 매큐셀’ 병용요법은 라핀나캡슐 150mg을 1일 2회, 매큐셀정 약 2mg을 1일 1회 병용해 경구투여한다.9
라핀나캡슐은 2014년 9월 BRAF V600E 변이가 확인된 수술이 불가능하거나 전이성인 흑색종 환자의 단독요법 치료제로 식품의약품안전처 승인을 받고 50mg과 75mg으로 국내에서 출시된 바 있으며,10,11 매큐셀정은 2015년 10월 BRAF V600E 또는 V600K 변이가 확인된 수술이 불가능하거나 전이성인 흑색종 환자의 단독요법 치료제로 처음 국내 허가를 받고 0.5mg 및 2mg으로 출시된 바 있다.10,12
[임상연구에 대하여]7
이 연구는 글로벌∙다기관∙다중 코호트∙비무작위∙비비교∙오픈 라벨의 2상 연구로서 BRAF V600E 변이 양성 전이성 비소세포폐암 환자를 대상으로 실시했다.
연구에 참여한 환자들은 3개 코호트로 분류됐는데, BRAF 억제제 라핀나 단독치료군 (Cohort A)과 라핀나 매큐셀 병용투여군 (Cohort B: 이전에 백금기반 화학요법 치료를 받은 환자 57명, Cohort C: 이전에 치료 경험이 없는 환자 36명)으로 구분됐다.
화학요법 치료를 받은 적 있는 BRAF V600E 변이 양성 비소세포폐암 환자 57명과 치료 경험이 없는 동일 질환 환자 36명은 라핀나(150mg, 1일 2회)와 매큐셀(2mg, 1일 1회)을 매일 병용 투여 받았다.5,6
치료 경험이 없는 환자들에게 라핀나 매큐셀을 병용투여 한 후 평균 15.9개월 동안 추적 조사한 결과, 전반적인 반응률(investigator-assessed ORR)은 64% (총 36명 중 23명)로 나타났다. (95% 신뢰구간[CI]: 46–79). 라핀나 매큐셀에 반응을 보인 환자 23명 중 2명(6%)은 완전반응(CR: Complete Response), 21명(58%)은 부분반응(PR: Partial Response)을 보였다. 반응지속기간(investigator-assessed DoR) 중앙값은 10.4개월(95% 신뢰구간[CI] 8·3–17·9)이었다. 이 병용요법의 무진행생존기간(investigator-assessed PFS) 중앙값은 10.9개월 (95% 신뢰구간[CI]: 7·0–16·6)이었으며, 전체 생존기간(OS) 중앙값은 24.6개월로 나타났다. (95% CI 12·3–비 추정).
라핀나 매큐셀 병용임상에 참여한 모든 환자들은 1-2가지 이상의 이상반응을 보였으며, 병용요법 시 전체 환자의 30% 이상에서 주로 나타난 이상반응은 발열, 구역질, 설사, 피로감, 말초 부종, 식욕저하, 건조증, 구토 등이었다.
한편, 연구의 1차 유효성 평가변수(Primary endpoint)는 연구자 평가(investigator-assessed)에 따른 전반적 반응률(ORR), 2차 유효성 평가변수(Secondary endpoint)는 무진행생존기간(PFS), 반응지속기간(DoR), 전체 생존기간(OS), 안전성 프로파일 및 내약성 등이었다.
[1] 객관적 반응률(ORR, Overall Response Rate): 최소 기간 동안 기정의된 종양크기 축소를 보이는 환자 비율
[2] 반응지속기간(DoR: Duration of Response): 암이 사라진 후 어느 정도 기간 후에 다시 생기는 것을 재발 또는 재현이라고 한다. 위축되었던 암이 다시 성장하기시작하면 이를 진행이라고 한다. 재발 또는 진행까지의 시간이 반응기간이다
[3] 무진행생존기간(PFS, Progression-Free Survival): 무작위 배정부터 객관적인 종양진행 혹은 사망까지의 시간
[4] 전체생존기간(OS, Overall Survival): 무작위배정부터 사망 까지의 시간
References
1 건강보험심사평가원 공고 제 2020-28
2 Paik P, et al. J Clin Oncol. 2011;29(15):2046-2051
3 Kris MG, et al. JAMA. 2014;311(19):1998-2006;
4 Kinno T, et al. Ann Oncol. 2014;25:138-142;
5 FDA grants regular approval to dabrafenib and trametinib combination for metastatic NSCLC with BRAF V600E mutation
6 David Planchard, Benjamin Besse, Harry J M Groen, et al. An open-label phase 2 trial of dabrafenib plus trametinib in patients with previously treated BRAF V600E–mutant metastatic non-small cell lung cancer, Lancet Oncol. 2016 July ; 17(7): 984–993
7 David Planchard, Egbert F Smit, Harry J M Groen, et al.Dabrafenib plus trametinib in patients with previously untreated BRAFV600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol. 2017; 18: 1307–16
8 건강보험심사평가원 공고 제2017-228호. ‘암환자에게 처방 투여하는 약제에 대한 요양 급여의 적용기준 및 방법에 관한 세부사항’ 개정 공고. 2017.10.30
9 식품의약품안전처 온라인의약도서관. 매큐셀정2밀리그램(트라메티닙디메틸설폭시드) 허가사항.
10 식품의약품안전처 온라인의약도서관. 라핀나캡슐50밀리그램(다브라페닙메실산염) 허가사항.
11 식품의약품안전처 온라인의약도서관. 라핀나캡슐75밀리그램(다브라페닙메실산염) 허가사항.
12 식품의약품안전처 온라인의약도서관. 매큐셀정0.5밀리그램(트라메티닙디메틸설폭시드) 허가사항.