항암신약 기술&시장동향
(인제대학교 혁신치료연구센터, 최인학)
1. 면역관문단백질의 기능 및 치료제 개발 배경
지금으로부터 약 20년 전에 T세포의 면역 활성과 억제에 관련된 새로운 면역조절 단백질들이 밝혀지면서, 이들의 복잡한 상호작용 네트워크에 의해 면역세포, 특히 T세포의 기능이 세밀히 조절된다는 사실이 규명되기 시작했다. 이러한 면역조절기전에 대한 이해를 바탕으로 암환자의 면역세포를 활성화시키는 기술이 10여년 전부터 개발되었고, 환자의 면역세포를 이용하여 암을 치료하는 항암면역치료의 지평이 새롭게 열리게 되었다.
기본적으로 암환자의 면역세포는 암 항원에 대해 내성(tolerance)이 생겨서 암세포를 인식할 수는 있지만 기능적으로는 억제되어 있어서 암세포를 효과적으로 제거하지 못한다. 내성에 빠진 면역세포를 깨워서 활성화된 면역세포로 유도하여 암세포를 파괴하는 것이 면역치료의 핵심이다. 이러한 면역치료에는 인터페론감마, IL-2 등 사이토카인 치료제, 수지상세포를 이용한 암백신, T 세포를 이용한 세포치료제, 면역억제 단백질을 차단하는 면역관문 저해제 (immune checkpoint inhibitor, ICI)등이 있으며, 이러한 치료제를 통상적으로 면역항암제(immuno-oncology therapy)라고 부른다. 그 중에서도 국제적인 제약회사들이 경쟁적으로 개발하고 있는 면역항암제는 면역관문 저해제일 것이다.
면역관문단백질 (immune checkpoint protein)은 세포막 단백질로서 면역세포의 분화, 증식, 활성을 억제한다. 좀 더 자세히 이야기 한다면, 이 단백질은 대체로 활성화된 T 세포에서 발현되어서, T 세포의 증식, 사이토카인 분비, 세포독성을 감소시키고, T 세포의 과도한 활성을 억제하는 기능이 있기 때문에 co-inhibitory 분자라고도 불린다. 대표적으로 T 세포에는 co-inhibitory 수용체인 CTLA4와 PD1이 발현되어 있어서 각각의 리간드인 B7.1/B7.2혹은 PDL1과의 결합을 통해 T 세포의 활성을 조절하게 된다.
다양한 암 조직에 대해 면역조직화학염색(IHC)을 한 결과를 분석하여 특정 면역관문단백질, 특히 PDL1은 면역세포뿐 아니라 암세포에서도 발현되어 있음을 알게 되었다. 특히 식도암, 위장관암, 췌장암, 유방암, 폐암, 신장암에서 PDL1의 발현이 높은 것으로 보고되고 있다. 암세포에서 발현된 PDL1은 암 특이적인 T 세포를 비활성화시키고 세포사멸을 유도하여 T 세포의 면역공격으로부터 암세포를 보호해 주는 중요한 분자방패(molecular shield) 역할을 하고 있어서 암의 면역회피 기전이 되기도 한다. 또한 암세포에 이소성 (ectopic)으로 PDL1이 발현된 암환자는 그렇지 않은 암환자에 비해 예후가 더 나쁜 것으로 보고되고 있다
따라서 이러한 결과들은 면역관문 단백질이 좋은 암 치료 표적이 될 수 있음을 시사해 준다. 실제로 여러 동물 암 모델에서 CTLA4, PD1 PDL1을 항체로 차단하였을 때 암의 성장이 억제되고, 생존율이 증가하는 것이 확인되었다. 이러한 치료효과는 면역 관문단백질의 억제신호가 차단되어 암특이적인 T 세포가 활성화되는 기전으로 설명된다. 이러한 동물실험 결과를 바탕으로 많은 임상시험이 디자인되어 진행되었으며 암종에 따라 차이는 대략 20-60%의 객관적 치료반응율 (objective response rate, ORR), 20-30%의 전생존율(overall survival, OS)을 보여서 기존의 항암제 치료보다 훨씬 높은 치료효과를 나타내고 있다.
그동안의 임상경험을 통해 면역관문저해제가 일반 항암제치료와 다른 몇가지 특징이 있음을 알게 되었다. 즉, 면역관문저해제에 대해 반응을 보이는 환자는 지속적으로 치료효과를 보이며, 치료를 중단한 후에도 치료효과가 지속되는 점, 암환자의 면역세포가 타겟이므로 다양한 암종에 대해 치료효과를 보이는 점, 65세 이상 고령의 환자에서도 젊은 환자와 비슷한 치료효과를 보이는 점, 치료과정에서 부작용이 적어서 삶의 질을 유지할 수 있는 점 등이 기존 항암제 치료를 받은 환자에서 볼 수 없는 특징이 된다.
2. 면역관문저해제 개발현황
면역관문저해제의 우수한 임상 치료성적이 보고되면서 많은 빅파마들이 경쟁적으로 면역관문저해제 개발에 뛰어들고 있다. 일부 저해제는 이미 미국 FDA 승인을 획득하여 치료제 시장에 나왔으며 전체 항암제 치료시장에서의 점유율을 점점 확대시켜 나가고 있다.
CTLA4 저해제인 이피리무맙(ipilimumab (Yervoy))이 면역관문저해제 중에서는 처음으로 전이 흑색종에 대한 2차 치료제로 2011년 FDA 승인을 획득하였다. 이후 2014년 PD1 차단제인 니보루맙 (nivolumab (Opdivo))과 펨브리로주맙(pembrolizumab (Keytruda))이 전이 흑색종에 대해 각각 FDA 승인을 획득하였다.
이후 PDL1에 대한 면역관문저해제인 아테조리주맙(atezolizumab(Tecentriq))이 방광암에 대해서(2016년), 아베루맙(avelumab (Bavencio))이 피부암 일종인 전이 머클세포암 치료에, 더바루맙(durvalumab (Imfinzi))이 방광암에 대해서 2017년에 FDA 승인을 획득하였다. 2018년에는 PD1 저해제인 케미프리맙 (cemiplimab(Libtayo))가 피부편평상피암에 대해 FDA 승인을 얻었다. 종합하여 보면 CLTA4를 표적으로 하는 저해제 1종, PD1 저해제 3종, PDL1 저해제 3종이 총 7종의 면역관문 저해제가 FDA 승인을 얻어 환자치료에 사용되고 있다. 현재 이들 약제는 치료적응증을 확대하면서 점점 더 많은 암종의 치료에 대해 FDA 승인을 얻고 있다. 2019년 현재 6종의 PD1-PDL1 저해제는 총 18개 암종에 대해 FDA 승인을 얻고 있다.
현재 많은 신규 타겟들이 전임상시험 및 초기임상시험 영역으로 유입되고 있다. 기존의 CLTA4, PD1, PDL1 이외에 LAG3, TIM3, TIGIT 등 면역관문단백질과 indoleamine dioxygenase (IDO), 아데노신 A2A 수용체 등 면역억제 대사에 관련된 타겟을 표적으로 저해제가 개발되어 임상1-2상 시험중에 있다. 최근에는 B7-H4, ICOS, HVEM, PDL2, PVRIG 등 면역조절단백질 등이 새롭게 전임상시험에 진입하고 있다. 대부분의 이러한 치료제들은 T 세포상에 발현되어 있는 타겟을 표적으로 하고 있다. 이렇게 T 세포 중심의 편향적인 타겟발굴 경향을 극복하기 위해 최근에는 대식세포, 수지상세포 등 myeloid 계열의 세포에서 발현되는 면역관문단백질을 표적으로 하는 저해제들이 개발되고 있다. 이중에 CSF1R, CD47, TLR7 등이 중요한 타겟으로 부상되고 있다. 앞으로 이들 타겟들에 대한 면역학적 기능 및 전임상 시험 결과들이 발표되면서 좀더 다양한 면역관문저해제들이 개발될 것으로 기대된다.
3. 면역관문저해제에 대한 내성에 대한 최신지견
면역관문저해제들이 높은 치료반응율을 보이고 있으나 여전히 많은 환자들이 치료에 반응하지 않으며, 많지는 않지만 일부의 환자에서는 치료 중간에 암이 재발되는 등 치료내성을 보이고 있다. 현재 많은 임상시험결과 및 차세대 유전자분석기술을 이용한 분자프로파일링을 통해 저해제에 대한 치료무반응 혹은 치료내성에 대한 기전이 속속 제시되고 있다. 이 중에서 몇가지를 소개하면 다음과 같다.
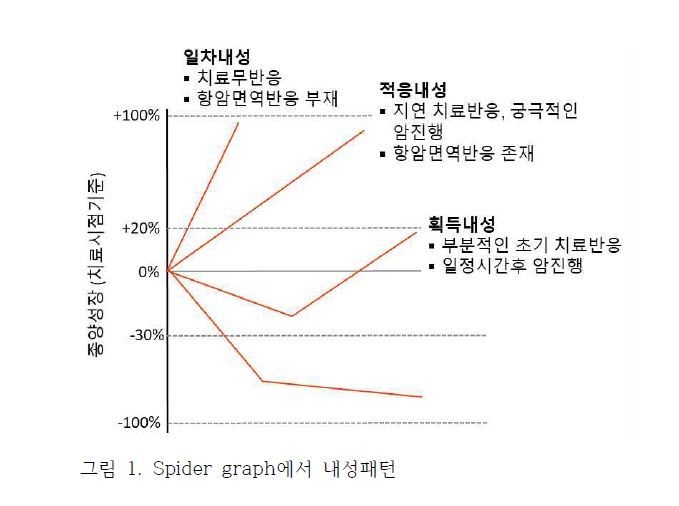
면역관문저해제 치료를 받은 암환자들의 치료반응에 대한 스파이더 그래프 (spider graph)를 기준으로 분석하면 치료에 반응하는 그룹과 반응하지 않는 그룹으로 나뉘게 되고, 다시 치료에 반응하지 않는 환자들은 다음과 같은 3가지 반응(내성)패턴을 나타내게 된다(그림 1). 즉, 그림에서 보듯이 치료에 대한 반응이 전혀 없이 종양이 커지는 경우(일차내성), 치료에 대해 반응이 늦게 나타나지만 궁극적으로 암이 커지는 경우(적응내성), 처음에는 치료에 반응하여 암이 줄어들지만 유지되지 못하고 다시 커지는 경우(획득내성) 들이다.
1) 일차내성
PD1 저해제 치료에 반응하지 않는 일차내성 (IPRES, innate PD1 resistance)이 대표적이다. PD1 저해제 치료를 받은 환자의 치료전 암조직에 대해 whole exome sequencing, RNA sequencing한 결과, 치료에 반응하지 않은 환자의 암조직에서는 IL-10 등 면역억제 사이토카인과 혈관형성인자인 VEGF, FLT1, ANGPT2 등이 증가 되어있다. 또한 단핵구/대식세포 유인인자인 CCL2, CCL7, CCL13 등의 증가, 상피-중배엽 전이(EMT) 인자인 AXL, ROR2, LOXL2, TWIST2 등의 발현이 증가되어 있다. 그러므로 치료전에 암조직에서 이러한 유전자 프로파일링을 조사한다면 PD1 저해제에 대해 반응하지 않을 환자를 미리 예측할 수 있을 것이다. 또한 최근 Skoulidis 등에 의해 종양억제인자인 STK11 (혹은 LKB1)의 소실에 의한 내성기전이 소개되었다. 즉, STK11이 소실되면 MYC, TGF-B, WNT/B-catenin 경로들이 활성화 되어 T 세포, B 세포, NK 세포, CD103+ 수지상세포들이 암조직내로 유입되지 않아서 암조직내 면역세포의 침윤이 없는 이른바 “cold” tumor를 형성하게 되어 면역치료에 내성을 보이게 된다.
2) 적응내성
암조직내로 유입된 종양특이적인 T 세포에 의해 분비되는 효과(effector) 사이토카인/케모카인에 의해 오히려 암이 PD1-PDL1 저해제에 대해 내성을 나타내는 경우를 말한다. T 세포가 암을 인식하면 IFN-γ를 분비하여 암세포를 죽이게 된다. 그런데 이 과정에서 IFN-γ는 암세포내의 JAK2-STAT1-IRF1 경로를 통해 암세포에서 PDL1의 발현을 크게 유도한다. 이렇게 유도된 PDL1은 T 세포의 PD1을 통해 T 세포를 억제하여 저해제치료에 반응하지 않게 된다. 이와 비슷한 예로 종양특이 T 세포에서 분비되는 TNF-α가 히스톤 메틸화효소인 Ezh2를 과발현시키고 이 효소에 의해 면역세포의 유입을 유도하는 CXCL9, CXCL10등의 케모카인 생산이 억제되고, MHC class I 분자의 발현을 억제하여 암의 면역원성이 감소되고, 면역세포유입이 차단되어 결국 면역치료에 내성을 보이게 된다.
3) 획득내성
면역관문저헤제 치료 초기에 암의 크기가 줄어드는 등 반응을 보이는 암환자들은 치료효과가 지속되는 것으로 알려져 있지만 일부의 환자에서는 다시 암이 진행되거나 새로운 부위에 암이 발생할 수 있는데 이런경우를 획득내성이라고 한다. 이렇게 재발된 부위의 암조직을 대상으로 whole exome sequencing, RNA sequencing 등을 통해 유전자를 분석해 보면 내성암에서 특히 항원제시기구 (antigen presentation machinery)와 관련된 유전자에 변이가 발생하거나 소실되는 경우가 많다. 암특이적인 T 세포는 MHC class I 단백질을 통해 제시된 암항원 펩티드를 인식해서 암을 공격한다. 그렇기 때문에 MHC class I 단백질의 구성이 올바르지 못하면 T 세포가 적절히 암세포를 인식할 수 없다. 획득내성인 경우, 재발된 암세포에서 MHC class I 단백질을 구성하는 β2-microglobulin (B2M) 유전자가 소실되거나 변이가 발생되어 있고, 암세포내에서 암항원 펩티드를 MHC에 전달하는데 중요한 기능을 하는 TAP 유전자가 소실되는 등 전반적으로 암항원제시 기능이 소실되어 있다. 이러한 변이로 인해 암의 면역원성이 감소되어 T 세포가 암세포를 제대로 인식하지 못하므로 치료에 내성이 생기게 된다.
또한 T 세포가 분비한 IFN-γ는 암세포에 발현되 IFN-γ 수용체를 통해 세포독성을 나타내어 암세포를 죽이게 된다. 내성암의 경우, 이 IFN-γ 수용체 신호경로에 있는 중요한 신호분자인 JAK1/2, STAT1 단백질이 소실되거나 발현이 극히 약하여서 T 세포에서 분비된 IFN-γ의 세포독성효과에 대해 반응하지 않게 되어 결과적으로 T 세포에 의한 종양세포 사멸에 대해 내성을 가지게 된다. 또한 암세포의 암항원단백질에 변이가 발생하면 이적 단백질과는 전혀 다른 서열을 가지는 새로운 단백질이 형성되고 이러한 변이단백질은 암항원특이적인 면역반응을 강하게 유도하는 경향이 있다. 이러한 신생항원(neoantigen)은 microsatellite instability (MSI)가 높은 암이나 손상된 DNA를 수복시키는 DNA repair system에 결손이 있는 암에서 많이 발생하며, 이들 신생항원의 높은 면역원성에 의해 PD1, PDL1 저해제에 반응이 좋은 것으로 알려져 있다. 최근의 보고에 의하면 치료중에 이미 형성되어 있던 신생항원이 소실되는 경우가 발생하고 이런 경우에 T 세포에 의한 면역공격이 불가능하게 되어 면역치료에 내성을 나타내게 된다.
이상에서 면역치료시 볼 수 있는 대표적인 내성과 그 발생기전을 소개하였으나 아직 면역관문저해제 치료에 대한 반응과 내성에 관한 자세한 생물학적 특성규명과 이해가 부족하여 앞으로 이 부분에 대한 연구가 많이 진행되어야 할 것이다.
4. 면역관문저해제 병용치료의 개발현황
CTLA4, PD1, PDL1 저해제 등 면역관문저해제의 단독치료시 볼 수 있는 가장 큰 제한점은 일부의 환자에서만 치료효과를 보이고 40-70%내외의 암환자들은 치료에 반응을 보이지 않는다는 점이다. 따라서 이러한 치료한계를 극복하기 위해서는 기존 치료반응율보다 향상된 치료효과를 나타내면서 부작용을 최소화하는 치료기술이 개발되어야 한다. 이를 위해 현재 기존 면역관문저해제를 기본적으로 사용하면서 다양한 항암기전을 가지는 치료제들을 병용적으로 사용하는 임상시험이 많이 진행중에 있다. 예를 들면, 2017년 한해에 PD1/PDL1 저해제의 병용치료에 대해 1,100건 임상시험이 진행되었으나 2018년에는 600여건이 증가한 1,700건의 임상시험이 진행되었다. 사실 2018년에 시행된 PD1/PDL1 저해제 단독 및 병용치료를 포함한 전체 임상시험이
2,250건임을 고려한다면 병용치료가 76% 정도 차지할 정도로 현재 면역관문저해제 치료는 이미 병용치료가 대세를 이루고 있음을 알 수 있다. 저해제별로 보면, 펨브로리주맙과 니보루맙을 기본으로 하는 병용치료가 2018년에도 1,090건(63%)으로 PD1/PDL1 저해제 병용치료의 대부분을 차지함을 알 수 있다.
병용치료에서 중요한 것은 기존 면역관문저해제와 항암기전이 중복되지 않으면서 시너지효과를 극대화 할 수 있는 파트너 치료제를 선택하는 것이다. 이점을 고려하면 면역치료제와 항암기전이 전혀 다른 표적항암제나 화학항암제가 대부분의 병용치료 파트너로 이용되고 있는 것은 어쩌면 당연하한 추세라 할 수 있다. 실제로 FDA 승인을 얻은 PD1/PDL1 저해제 병용치료 10건 중에서 6건이 항암제와의 병용치료이며, 3건이 CLTA4 저해제와의 병용치료이다.
PD1/PDL1 저해제 병용치료의 파트너 치료제의 타겟을 분석해 보면 2019년 현재 총 240개 타겟에 대한 치료제가 파트너로 사용되고 있다. 이 중 상위 38개 타겟에 대한 치료제와의 병용치료가 전체 병용치료의 77%를 차지하고 있다. 대표적인 파트너 치료제로는 암세포 특이적인 인산화효소를 억제하는 표적항암제, 일반 항암제와 LAG3, TIM3, TIGIT 저해제와 같은 다른 면역관문저해제 등이 사용되고 있다. 기타 병용치료 파트너로는 OX40, CD40, ICOS 항체 등 면역활성조절제 (immune modulator), IDO와 아데노신 A2A 수용체 항체 등 대사저해제, 방사선치료 등이 사용되고 있다. 특히 최근에 후생유전학조절제(epigenetic modifier)가 새로운 파트너 치료제로 주목받고 있다. 이는 면역관문저해제 치료에 대한 획득내성 기전 중 하나인 소실/억제되어 있던 암세포의 항원제시기구에 관여된 B2M, TAP 유전자 등이 후생유전학조절제인 히스톤 탈아세틸효소(HDAC) 억제제, DNA 메틸전이효소 (DMT) 억제제 등에 의해 발현이 유도되어 면역관문저해제에 대한 암의 감수성을 다시 증가시켜 내성을 극복시키기 때문이다.
현재까지 면역관문저해제는 이전의 어떤 항암치료제보다 우수한 임상결과와 이전에는 경험해 보지 못했던 지속적인 치료효과를 보이면서 면역항암제의 대표 주자가 되어 왔다. 그러나 치료에 반응하지 않는 많은 환자군이 존재하는 것이 밝혀지면서 면역관문저해제 단독치료의 한계를 극복하기 위해 다른 항암제치료와 병용치료가 시행되고 있다. 현재 대부분의 병용치료는 치료제의 단독사용에서 얻은 임상적 결과를 바탕으로 경험적인 조합으로 치료하는 경향을 보였으나 향후에는 치료내성기전의 분자적, 면역학적 이해를 바탕으로 한 근거중심의 조합으로 치료전략을 세운다면 더 향상된 항암치료효과를 기대할 수 있을 것이다.
참고문헌
– Immune-Related Tumor Response Dynamics in Melanoma Patients Treated with Pembrolizumab: Identifying Markers for Clinical Outcome and Treatment Decisions. Clin Cancer Res. 2017 Aug 15;23(16):4671-4679
– Migrating into the Tumor: a Roadmap for T Cells. Trends in Cancer 2017 VOLUME 3 (11), P797-808
– Genomic and Transcriptomic Features of Response to Anti-PD-1 Therapy in Metastatic Melanoma. Cell. 2016 Mar 24;165(1):35-44
– STK11/LKB1 Mutations and PD-1 Inhibitor Resistance in KRAS-Mutant Lung Adenocarcinoma. Cancer Discov. 2018 Jul;8(7):822-835
– Anti–PD-1/PD-L1 therapy of human cancer: past, present, and future. J Clin Invest. 2015 Sep;125(9):3384-91
– The Histone Methyltransferase Ezh2 Controls Mechanisms of Adaptive Resistance to Tumor Immunotherapy. Cell Rep. 2017 Jul 25;20(4):854-867
– Mutations Associated with Acquired Resistance to PD-1 Blockade in Melanoma. N Engl J Med. 2016 Sep 1;375(9):819-29
– Evolution of Neoantigen Landscape During Immune Checkpoint Blockade in Non-Small Cell Lung Cancer. Cancer Discov. 2017 Mar;7(3):264-276
– Trial watch: The clinical trial landscape for PD1/PDL1 immune checkpoint inhibitors. Nat Rev Drug Discov. 2018 Nov 28;17(12):854-855