절제 불가능한 PD-L1 양성 국소 진행성·전이성 삼중음성 유방암 1차 치료에서 무진행생존기간(PFS)을 유의하게 개선
3상 IMpassion130 임상연구 결과 PD-L1 양성 환자 대상으로 2년 이상의 전체 생존기간(OS) 중간값 확인
㈜한국로슈(대표이사 닉 호리지)는 자사의 면역항암제 티쎈트릭Ⓡ(성분명 아테졸리주맙)이 1월 30일 식품의약품안전처로부터 PD-L1 양성인 수술적 절제가 불가능한 국소 진행성 또는 전이성 삼중음성 유방암 환자의 1차 치료에 알부민 결합 파클리탁셀과의 병용요법으로 적응증을 승인 받았다고 밝혔다.
호르몬 수용체와 표피성장인자(HER2) 수용체 모두가 음성임을 뜻하는 삼중음성 유방암은 유방암의 아형 중 특히 치료 예후가 불량한 아형으로, 기존 치료제 사용시 전이를 동반한 환자들의 전체 생존기간(OS, Overall Survival) 중간값이 13~18개월에 불과했다. 또한 사용 가능한 치료제 옵션이 적어 환자들의 생존기간을 유의하게 개선하는 새로운 치료 옵션에 대한 요구도가 높은 ‘유방암 치료의 불모지’였다. 특히 삼중음성 유방암은 전체 유방암 중 면역원성이 가장 높은 것으로 알려져, 향후 티쎈트릭Ⓡ을 비롯한 면역항암제가 효과적인 치료 옵션이 될 것으로 기대를 모으고 있다.
이번 티쎈트릭Ⓡ 병용요법의 적응증 허가는 18세 이상 절제 불가능한 국소 진행성 또는 전이성 삼중음성 유방암 환자 902명을 대상으로 한 다기관, 무작위 배정, 이중맹검 3상 임상연구인 IMpassion130 연구 결과를 기반으로 이뤄졌다.
연구 결과, 티쎈트릭Ⓡ+알부민 결합 파클리탁셀 병용요법은 PD-L1 양성(IC PD-L1≥1%) 환자에서 7.5개월(95% CI: 6.7-9.2개월)의 무진행생존기간(PFS, Progression-Free Survival) 중간값을 보여, 대조군(5.0개월, 95% CI: 3.8-5.6개월) 대비 질병 진행 및 사망 위험을 약 40% 낮췄다(HR=0.62 [95% CI: 0.49-0.78], P<0.001). 또한 티쎈트릭Ⓡ+알부민 결합 파클리탁셀 병용요법은 PD-L1 양성 환자에서 2년 이상(25.0개월, 95% CI: 19.6-30.7개월)의 OS 중간값을 나타냈다(HR=0.71 [95%CI: 0.54-0.94]).
PD-L1 양성 환자에서 각 투여군의 객관적 반응률(ORR, Objective Response Rate)은 티쎈트릭Ⓡ+알부민 결합 파클리탁셀 병용요법 투여군에서 58.9%, 대조군에서 42.6%로 티쎈트릭Ⓡ+알부민 결합 파클리탁셀 병용요법의 ORR이 유의하게 높았다(P=0.002). 또한 기존에 티쎈트릭Ⓡ 또는 알부민 결합 파클리탁셀의 이상반응으로 알려진 반응 이외에 새롭게 관찰된 이상반응은 없었다.
㈜한국로슈의 닉 호리지 대표이사는 “'유방암 치료의 불모지'였던 삼중음성 유방암에서 최초이자 유일한 면역항암제 기반 치료 옵션을 제공하게 되어 매우 기쁘게 생각한다”며, “이를 통해 유방암 환자들의 전체 치료 여정을 아우르는 로슈의 차별화된 유방암 포트폴리오를 강화해 나갈 수 있을 것으로 기대하며, 앞으로도 로슈는 암환자들에게 새로운 희망을 선사하기 위해 최선의 노력을 다하겠다”고 밝혔다.
한편 티쎈트릭Ⓡ은 2017년 1월 요로상피암 2차 이상 치료제로 국내 식품의약품안전처의 허가를 받아 출시됐으며, 국소 진행성 또는 전이성 삼중음성 유방암의 1차 치료 외에도 국소 진행성 또는 전이성 요로상피암 1차 치료와 비소세포폐암의 치료, 그리고 확장병기의 소세포폐암 1차 치료로도 허가되었다.
티쎈트릭®(성분명 아테졸리주맙)에 대하여
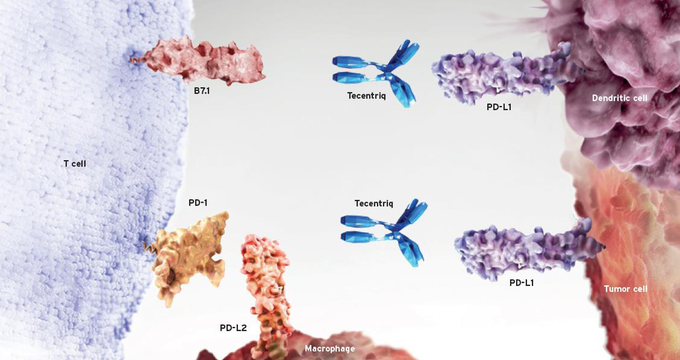
티쎈트릭®은 암세포와 암세포에 침윤된 면역세포의 PD-L1를 직접표적하는 폐암·요로상피암 최초의 항 PD-L1 면역항암제다. 티쎈트릭®은 암세포를 공격하던 기존 항암요법과 달리 인체의 면역기능을 이용하여 암세포를 공격하도록 하는 새로운 패러다임의 치료제다.7 또한 PD-1을 표적으로 하는 면역항암제와 달리 면역세포와 암세포의 PD-L1와 결합해 T-세포의 항암작용을 회복시킨다는 점에서 차이가 있다.7
이를 근거로 티쎈트릭®은 2017년 1월 요로상피암 치료제로 국내 식품의약품안전처의 허가를 받아 출시됐으며, 이후 비소세포폐암, 소세포폐암, 삼중음성유방암의 적응증이 추가되었다.1
† 현재 시점에서의 OS 데이터는 2차 중간분석자료로 최종 결과가 아니며, 통계학적 검증방법에 따라 PD-L1 양성환자에서의 OS 결과값에 대한 통계적 유의성 검증은 수행되지 않았음
IMpassion130 임상연구에대하여5,6
IMpassion130은 이전에 치료받은 경험이 없는 18세 이상 절제불가능한 국소진행성 또는 전이성 삼중음성 유방암환자 902명을 대상으로 티쎈트릭®+알부민 결합 파클리탁셀 병용요법의 효과와 안전성을 연구한 다기관, 무작위배정, 이중맹검 3상임상시험이다.6 연구참여자들은 티쎈트릭®+알부민 결합 파클리탁셀 병용요법 투여군과 위약+알부민 결합 파클리탁셀 투여군에 1:1로 배정되었다.6 1차평가변수는 전체생존기간(OS)과 무진행생존기간(PFS)이었으며††, 2차평가변수는 객관적반응률(ORR) 및 반응지속기간이었다.6
IMpassion130 임상연구에 참여한 PD-L1 양성환자군에서의 주요 결과는 다음과 같다.
• PD-L1 양성환자에서 티쎈트릭®+알부민 결합 파클리탁셀 병용요법 투여군의 PFS 중간값(7.5개월, 95% CI: 6.7-9.2개월)은 대조군(5.0개월, 95% CI: 3.8-5.6개월) 대비 2.5개월 더 길게 나타남(HR=0.62 [95% CI: 0.49-0.78], P<0.001).6
• PD-L1 양성환자에서 OS 중간값†은 티쎈트릭®+알부민 결합 파클리탁셀 병용요법 투여군에서 25.0개월(95% CI: 19.6-30.7개월), 대조군에서 18.0개월(95% CI: 13.6-20.1개월)로 임상적으로 의미있는 향상을 보였음(HR=0.71 [95% CI: 0.54-0.94]).5
• PD-L1 양성환자에서 각 투여군의 ORR은 티쎈트릭®+알부민 결합 파클리탁셀 병용요법 투여군에서 58.9%(95% CI: 51.5-66.1), 대조군에서 42.6%(95% CI: 35.4-50.1)였음.6 또한 PD-L1 양성환자에서의 완전관해율(CR, Complete Response)은 티쎈트릭®+알부민 결합 파클리탁셀 병용요법 투여군에서10.3%(95% CI: 6.3-15.6), 대조군에서 1.1%(95% CI: 0.1-3.9)로 나타남.6
• 반응지속기간의중 간값은 PD-L1 양성, 티쎈트릭®+알부민 결합 파클리탁셀 병용요법 투여군에서 8.5개월(95% CI:7.3-9.7개월), 대조군에서 5.5개월(95% CI: 3.7-7.1개월)로나타남.6
• IMpassion 130 연구에 참여한 전체환자중 티쎈트릭®+알부민 결합 파클리탁셀 병용요법 투여군에서 가장 흔하게 나타난 이상반응은 탈모(56.4%), 구역(46.0%), 기침(24.8%), 말초신경병증(21.7%), 호중구감소증(20.8%) 순이었음.6
㈜한국로슈에 대하여
㈜한국로슈는 세계 1위의 바이오제약사인 로슈그룹의 한국내 법인으로 지난 1983년 설립되었으며, 로슈그룹의 제약사업부문인 ㈜한국로슈와 진단사업부문인 ㈜한국로슈진단이 국내에 운영중이다. 혁신(innovation)을 최우선으로 지향하는 로슈그룹의 전략에 따라 ㈜한국로슈는 항암제, 면역억제제, 간염치료제, 항바이러스제 등 다양한 분야에서 선두적인 혁신의약품을 제공하고 있으며, 세계수준의 다국적 임상시험을 적극 유치하고, 세계적 수준의 국내 의료진이 더욱 발전할 수 있도록 다양한 의학포럼을 개최하는 등 한국의료사회 발전에 기여하고 있다. 또한, ㈜한국로슈는 지역사회의 일원으로서 책임감 있는 기업으로 환자들의 삶의 질 향상을 위해 노력하고 있다. ㈜한국로슈는 2007년부터 로슈그룹의 글로벌 사회공헌활동인 ‘어린이를 위한 걷기대회(Children’s Walk)’에 참여하고 있으며, 2012년부터 암환우들의 예술활동 지원 사회공헌 프로그램인 ‘힐링갤러리(Healing Gallery)’를 지속적으로 진행해 왔으며, 2018년에는 NGO 굿피플과 함께 기존의 ‘힐링갤러리’에 환자맞춤형 지원이 더욱 강화된 ‘힐링투게더(Healing Together)’를 런칭했다. 회사에 관한 자세한 정보는 홈페이지(www.roche.co.kr)에서 확인할 수 있다.
† 현재 시점에서의 OS 데이터는 2차 중간분석자 료로 최종결과가 아니며, 통계학적 검증방법에 따라 PD-L1 양성환자에서의 OS 결과값에 대한 통계적 유의성 검증은 수행되지 않았음
†† 1차평가변수: PFS는 ITT(intention-to-treat, 치료의도집단)군및 PD-L1 양성군 모두에서 분석했으며, OS는 ITT 군에서 통계적 유의성을 보이는 경우에 한해 PD-L1 양성군에서 그 유의성을 검증함
Balar AV, et al. Atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. Lancet2017;389:67-76.doi: 10.1016/S0140-6736(16)32455-2. (IMvigor210 cohort 1)
References
2 Garrido-Castro AC, et al. Insights into Molecular Classifi cations of Triple-Negative Breast Cancer: Improving Patient Selection for Treatment. Cancer Discovery. 2019;9(2):176-198.
3 Park JH, et al. How shall we treat early triple-negative breast cancer (TNBC): from the current standard to upcoming immuno-molecular strategies. ESMO Open 2018;3:e000357.
4 Kwa MJ, Adams S. Checkpoint inhibitors in triple-negative breast cancer (TNBC): where to go from here. Cancer. 2015;124(10):2086-2103
5 Schmid P. et al. Atezolizumab plus nab-paclitaxel as first-line treatment for unresectable, locally advanced or metastatic triple-negative breast cancer (IMpassion130): updated efficacy results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet oncol2020;21:44-59
6 Schmid, P., Adams, et al. Atezolizumab and nab-paclitaxel in advanced triple-negative breast cancer. New England Journal of Medicine, 379(22), 2108-2121.
7 Balar AV, et al. Atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma: a single-arm, multicentre, phase 2 trial. Lancet2017;389:67-76.doi: 10.1016/S0140-6736(16)32455-2. (IMvigor210 cohort 1)