수술 후 보조요법으로 퍼제타·허셉틴 병용 투여 시 기존 치료요법 대비 재발 위험 감소 효과 확인
호르몬 수용체 양성 여부와 무관하게 기존 치료보다 개선된 무침습질병생존(iDFS) 보여
㈜한국로슈(대표이사 닉 호리지)는 HER2 양성 조기 유방암 치료에서 퍼제타(성분명 퍼투주맙)·허셉틴(성분명 트라스투주맙) 병용요법이 기존 치료요법 대비 장기적인 관점에서 보다 개선된 재발위험 감소효과를 보였다고 밝혔다.
12월 11일 2019 샌안토니오 유방암 심포지엄(SABCS, San Antonio Breast Cancer Symposium)에서 발표된 APHINITY 임상연구 6년 차 추적관찰 결과에 따르면, HER2 양성 조기 유방암 환자의 수술 후 보조요법으로 퍼제타·허셉틴 병용 투여 시 기존 허셉틴 단독요법 대비 무침습질병생존(iDFS, invasive disease free survival)을 개선하며 재발 위험 감소 효과를 보였다.[1]
이는 지난 APHINITY 임상연구 3년 차 추적관찰 결과보다 개선된 수치일 뿐 아니라 특히 기존 치료요법 대비하여 장기적인 관점에서 우수한 치료 효과가 확인됐다는 점에서 의미를 갖는다.
이번에 공개된 APHINITY 임상연구 6년 차 추적관찰 결과에 따르면, 퍼제타∙허셉틴 병용요법은 HER2 양성 조기 유방암 환자의 수술 후 보조요법으로 6~8주기의 화학요법과 함께 투여했을 때 기존 허셉틴 단독요법 대비 침습성 질환(invasive disease)†의 위험을 24% (HR=0.76 [95% CI: 0.64-0.91]) 낮췄다.[1]
또한 APHINITY 임상연구 하위 분석 결과, 퍼제타∙허셉틴 병용요법은 재발 고위험군 환자에서 보다 큰 재발 위험 감소 효과를 보였다.[1] 림프절 전이 양성 환자군의 경우, 퍼제타∙허셉틴 병용 투여 시 재발 위험이 28% (HR=0.72 [95% CI: 0.59-0.87]) 감소했다. 뿐만 아니라 퍼제타·허셉틴 병용 투여군에서 무침습질병생존 개선 효과는 호르몬 수용체 양성 여부와 무관하게 나타났다. 분석 결과, 호르몬 수용체 양성 환자군의 재발 위험은 27% (HR=0.73 [95% CI: 0.59-0.92]), 호르몬 수용체 음성 환자군의 재발 위험은 17% 감소한 것으로 확인됐다.(HR=0.83 [95% CI: 0.63-1.10][1]
이외 총 74.1개월의 추적관찰이 이뤄진 이번 6년차 데이터에서 새롭게 확인된 심장 관련 안전성 징후는 없었다.[1]
APHINITY는 HER2 양성 조기 유방암 환자 4,805명을 대상으로 수술 후 보조요법 치료에서 화학요법과 함께 투여하는 퍼제타∙허셉틴 병용요법과 허셉틴 단독요법의 유효성 및 안전성을 비교한 임상연구다.[2] 1차 평가변수는 기존 무질병생존(DFS, disease free survival) 대비 조기 유방암에서 재발 위험 감소 효과를 보다 정확하게 측정[3]할 수 있는 무침습질병생존(iDFS)으로 설계됐다.[2] 올해 발표된 6년차 데이터에 이어 APHINITY 임상연구의 세 번째 전체생존(OS, Overall Survival) 중간분석 추적관찰은 2022년으로 계획되어 있다.[4]
㈜한국로슈 항암제 사업부 크리스토프 위즈너(Christof Wiesner) 디렉터는 “HER2 양성 조기 유방암 중에서도 재발 고위험군으로 분류되는 환자는 치료 예후가 불량하기 때문에 기존 치료보다 개선된 치료 옵션이 절실했던 상황”이라며 “HER2 양성 조기 유방암 치료의 목표는 완치인 만큼, 이번 APHINITY 임상연구의 6년차 추적관찰 결과는 재발 고위험군 환자도 유방암 극복에 대한 더 큰 희망을 가지고 치료 받을 수 있다는 것을 보여주는 고무적인 성과”라 강조했다.
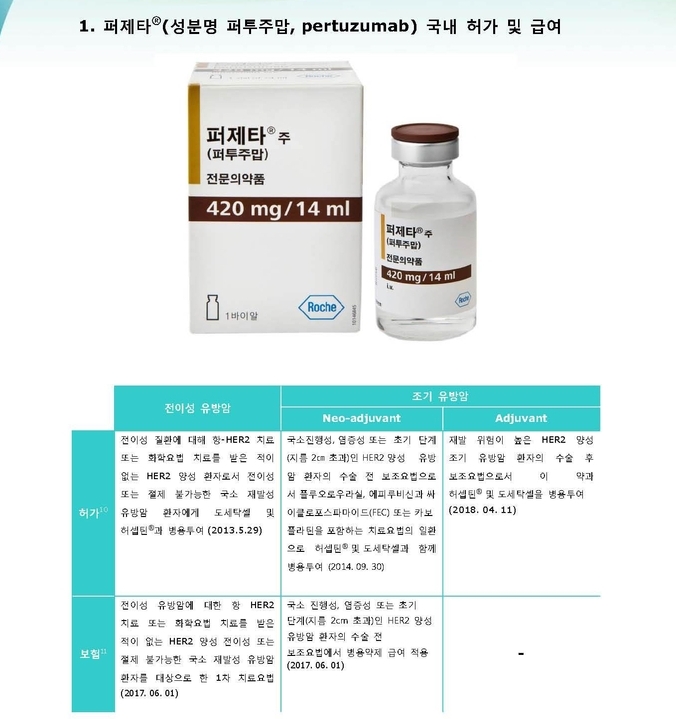
퍼제타는 세계 최초 HER2 이합체화 억제제로 허셉틴(성분명 트라스투주맙)과 상호보완적인 기전을 통해 암 세포의 성장을 차단한다.[5] 퍼제타는 2013년 5월 HER2 양성 전이성 유방암 치료제로 국내 허가를 획득한 이래 2014년 9월 HER2 양성 조기 유방암 환자의 수술 전 보조요법, 2018년 4월 HER2 양성 조기 유방암 환자의 수술 후 보조요법으로 적응증을 확대한 바 있다.[6] 현재 퍼제타는 HER2 양성 전이성 유방암에서 환자 본인부담비율 5%, HER2 양성 조기 유방암의 수술 전 보조요법에서 선별 급여 제도를 통해 환자 본인부담비율 30%로 건강보험급여를 적용받고 있다.[7],[8]
† 침습성 질환(invasive disease)은 동측의침습성 유방암 재발(recurrence of ipsilateral invasive breast tumor), 동측의침습성 질환 국소재발(recurrence of ipsilateral locoregional invasive disease), 원격 재발(a distant disease recurrence), 반대측 침습성 유방암(contralateral invasive breast cancer), 전체 사망(death from any cause)을 포함한다.
퍼제타®에 대하여
퍼제타®는 HDI(HER2 Dimerization Inhibitor, HER2 이합체화 억제제) 단일클론항체로, 트라스투주맙과 HER2 수용체의 서로 다른 부분에 작용함으로써 상호보완적으로 이합체화를 차단하여 암세포의 성장을 지연시킨다.[5] 퍼제타®는 CLEOPATRA임상연구에서 전이성 유방암 치료 사상 최장의 전체생존기간(56.5개월)을 입증했으며[9], 미국 NCCN 가이드라인은 이를 바탕으로 퍼제타®를 HER2 양성 전이성 유방암 1차 치료 옵션 중 선호요법(Category 1)으로 권고했다.[10] 아울러 퍼제타®는 HER2 양성 조기유방암 환자 대상 수술 전 보조요법 치료에서도 생존률 향상의 대체 지표(surrogate marker)로 간주되는 병리학적완전관해율(pathological complete remission rate) 측면에서 우수한 결과를 보여, 지난 2013년 미국 식품의약국(FDA)으로부터 신속승인을 획득했다.[11],[12]
퍼제타®는 2013년 5월 식품의약품안전처로부터 전이성 질환에 대해 항 HER2 치료 또는 화학요법 치료를 받은 적이 없는 전이성 또는 절제불가능한 국소재발성 유방암 환자의 트라스투주맙+도세탁셀 병용투여에 대해 국내 허가를 받았으며, 2014년 9월에는 국소진행성, 염증성 또는 초기 단계(지름 2cm 초과)인 HER2 양성 유방암 환자의 수술 전 보조요법으로서 플루오로우라실, 에피루비신과 싸이클로포스파마이드(FEC) 요법 또는 카보플라틴을 포함하는 치료요법의 일환으로 이 약과 트라스투주맙 및 도세탁셀을 병용투여하는 것에 대해 적응증을 획득한 바 있다.[6] 2018년 4월에는, 재발 위험이 높은 HER2 양성 조기 유방암 환자의 수술 후 보조요법으로서 이 약과 트라스투주맙 및 화학요법을 병용투여하는 것에 대해 적응증을 획득했다.[6]
국내 건강보험급여 적용 기준은 아래와 같다.
① 전이성 유방암에 대해 항 HER2 치료 또는 화학요법 치료를 받은 적이 없는 HER2 양성 전이성 또는 절제 불가능한 국소 재발성 유방암 환자 대상 1차 치료요법으로 투여하는 경우: 환자 본인부담비율 5%.[8]
② 국소진행성, 염증성 또는 초기 단계(지름 2cm 초과)인 HER2 양성 유방암 환자의 수술 전 보조요법에서 플루오로우라실,에피루비신과싸이클로포스파마이드 또는 카보플라틴을 포함하는 치료 요법의 일환으로 허셉틴®·도세탁셀과의 병용투여하는 경우: 퍼제타®주 환자본인부담비율 30%.[7]
③ 림프절 전이가 발견된 HER2 양성 조기 유방암 환자의 수술 후 보조요법으로서 이 약과 트라스투주맙 및 화학요법을 병용투여하는 경우: 퍼제타®를 제외한 트라스투주맙 및 화학요법에 대하여 환자 본인부담비율 5%, 퍼제타®주 환자본인부담비율100%.[7]
APHINITY 임상 시험에 대하여[2]
APHINITY는 HER2 양성조기유방암환자(n=4,805)를 대상으로 수술 후 보조요법치료에서 화학요법과 함께 투여한 퍼제타®·허셉틴® 병용 투여와 허셉틴® 단독요법의 유효성 및 안전성을 비교한 무작위배정∙다기관∙이중맹검∙위약비교 3상대조군 임상시험이다.[2]
임상시험에 참여한 환자들은 수술 후 6~8주기의 화학요법(안트라사이클린계 또는 탁산계 약물 기반 치료요법) 치료와 함께 총 1년(52주) 동안 퍼제타®·허셉틴® 병용 투여(n=2,400) 또는 위약·허셉틴® 병용 투여(n=2,404) 치료를 받았다.[2] 1차 평가변수는 침습성무병생존율(iDFS, Invasive disease free survival)이며, 침습성 유방암의 재발 또는 수술 후 보조요법 치료 후 모든 원인을 포함한 사망 사건 없이 환자가 생존한 기간을 기준으로 측정됐다.[2] 2차 평가변수는 전반적인 안전성, 전체생존율(Overall Survival), 침습성무병생존율(Secondary primary nonbreast cancer를 포함한 iDFS, STEEP definition), 무병생존율(Disease Free Survival)이다.[2]
임상연구에서 새롭게 확인된 안전성 징후는 없었으며, 가장 흔하게 보고된 Grade 3 이상의 이상반응은 설사, 빈혈, 호중구감소증이었다.[2] 두치료군에서 심부전, 심장질환으로 인한 사망, 심기능 이상은 모두 흔하지 않게 발생했고 Grade 3 이상의 설사는 대부분 화학요법 치료중 발생했으며, 퍼제타®군에서 위약군 대비 더 많이 발생했다(9.8% vs. 3.7%).[2] 6년차 추적관찰 결과에서도 새롭게 발견된 심장 관련 안전성 징후는 없는 것으로 확인됐다.[1]
APHINITY 임상시험 6년 차 침습성무병생존율(iDFS) 분석
결과[1]
|
|
|
퍼제타® + 허셉틴® + 화학요법
|
위약 + 허셉틴®
+ 화학요법
|
|
전체
환자 대상
(ITT Population)
|
90.6%
|
87.8%
|
|
HR=0.76 (95% CI, 0.64-0.91)
|
|
림프절
양성(LN+) 환자 군
|
87.9%
|
83.4%
|
|
HR=0.72(95% CI, 0.59-0.87)
|
|
호르몬
수용체 양성(HR+) 환자 군
|
91.2%
|
88.2%
|
|
HR=0.73 (95% CI, 0.59-0.92)
|
|
호르몬
수용체 음성(HR-) 환자 군
|
89.5%
|
87.0%
|
|
HR=0.83 (95% CI, 0.63-1.10)
|
㈜한국로슈에 대하여
㈜한국로슈는 세계 1위의 바이오 제약사인 로슈그룹의 한국 내 법인으로 지난 1983년 설립되었으며, 로슈그룹의 제약사업 부문인 ㈜한국로슈와 진단사업 부문인 ㈜한국 로슈진단이 국내에 운영 중이다.
혁신(innovation)을 최우선으로 지향하는 로슈그룹의 전략에 따라 ㈜한국로슈는 항암제, 면역억제제, 간염치료제, 항바이러스제 등 다양한 분야에서 선두적인 혁신 의약품을 제공하고 있으며, 세계 수준의 다국적 임상시험을 적극 유치하고, 세계적 수준의 국내 의료진이 더욱 발전할 수 있도록 다양한 의학 포럼을 개최하는 등 한국 의료사회 발전에 기여하고 있다.
또한, ㈜한국로슈는 지역사회의 일원으로서 책임감 있는 기업으로 환자들의 삶의 질 향상을 위해 노력하고 있다. ㈜한국로슈는 2007년부터 로슈그룹의 글로벌 사회공헌활동인 ‘어린이를 위한 걷기 대회(Children’s Walk)’에 참여하고 있으며, 2012년부터 암환우들의 예술활동 지원 사회공헌프로그램인 ‘힐링 갤러리(Healing Gallery)’를 지속적으로 진행해 왔으며, 2018년에는 NGO 굿피플과 함께 기존의 ‘힐링갤러리’에 환자맞춤형 지원이 더욱 강화된 ‘힐링투게더(Healing Together)’를 런칭했다.
회사에 관한 자세한 정보는 홈페이지(www.roche.co.kr)에서 확인할 수 있다.
References
[1] Piccart M, et al. Interim OS analysis of APHINITY (BIG 4-11): a randomised multicenter, double-blind, placebo-controlled trial comparing chemotherapy plus trastuzumab plus pertuzumab versus chemotherapy plus trastuzumab plus placebo as adjuvant therapy in patients with operable HER2-positive eBC. Presented at SABCS, 2019 Dec 10-14; San Antonio, Texas. Abstract #GS1-04.
[2] Von Minckwitz, G., et al. (2017). Adjuvant pertuzumab and trastuzumab in early HER2-positive breast cancer. N Engl J Med 2017; 377(2), 122-131.
[3] Hudis CA, Barlow WE, Costantino JP, et al. Proposal for standardized definitions for efficacy end points in adjuvant breast cancer trials: the STEEP system. J Clin Oncol 2007; 25:2127-2132.
[5] Roche (2012. 06. 11) FDA approves Roche’s Perjeta (pertuzumab) for people with HER2 positive metastatic breast cancer.
[6] 식품의약품안전처온라인의약도서관, 퍼제타주 (Accessed Nov. 2019)
[7] 건강보험심사평가원공고제 2019-158호
[8] 건강보험심사평가원공고제2017-132호
[9] Sandra M et al. Pertuzumab, Trastuzumab, and Docetaxel in HER2-Positive Metastatic Breast Cancer, N Engl J Med 2015;372:724-34
[10] NCCN Guidelines – Breast cancer version 3. 2019
[11] Pathological Complete Response in Neoadjuvant Treatment of High-Risk Early-Stage Breast Cancer: Use as an Endpoint to Support Accelerated Approval, FDA October 2014