얀센은 다잘렉스®주(성분명: 다라투무맙)가 지난 8월 21일 식품의약품안전처(이하 식약처)로부터 국내 다발골수종 환자의 1차 및 2차 병용요법 치료제로 허가 받았다고 밝혔다.
이번에 허가 받은 적응증은 총 3개로 ▲조혈모세포이식이 적합하지 않고 이전 치료 경험이 없는 다발골수종 환자의 보르테조밉, 멜팔란 및 프레드니솔론과의 병용요법(DVMP) ▲이전에 한 가지 이상 치료를 받은 다발골수종 환자를 대상으로 레날리도마이드 및 덱사메타손과의 병용요법(DRd) ▲이전에 한 가지 이상 치료를 받은 다발골수종 환자를 위한 보르테조밉 및 덱사메타손과의 병용요법(DVd)이다. 이로써 다잘렉스®주는 이전 치료 경험이 없는 다발골수종 환자부터 기존 치료 방법에 실패한 환자에게까지 다른 치료제와 함께 사용할 수 있게 됐다.
다잘렉스®주는 다발골수종에 최초로 허가된 인간 단일클론항체며, 주성분인 다라투무맙은 다발골수종 세포에 과발현 되어있는 표면 당단백질인 CD-38을 인지하여 직접 결합한다. 이번 적응증 확대는 다잘렉스®주 병용요법의 효과와 안전성을 입증한 3가지 임상연구를 근거로 이뤄졌다.
조혈모세포이식이 적합하지 않고 이전 치료 경험이 없는 다발골수종 환자를 대상으로 한 무작위 배정, 라벨공개, 활성대조군 3상 임상시험인 ALCYONE(MMY3007)에서 18개월의 분석시점을 기준으로 보르테조밉, 멜팔란, 프레드니솔론과 다잘렉스®주 병용 투여군(DVMP)의 무진행생존율은 71.6%로 보르테조밉과 멜팔란, 프레드니솔론 투여군(VMP)의 무진행 생존율 50.2% 대비 질환의 진행 및 사망위험이 50%가량 감소한 것으로 나타났다. (hazard ratio, 0.50; 95% confidence internal, 0.38-0.65; p<0.001). 또한, 대조군(VMP)의 무진행생존기간(progression-free survival, PFS) 중앙값이 18.1개월인 것에 비해 다잘렉스®주 병용 투여군(DVMP)은 분석 시점에도 중앙값에 도달하지 않았다(p<0.001).
전체반응률(ORR) 또한 다잘렉스®주 병용 투여군(DVMP)은 대조군(VMP)의 73.9%보다 유의하게 높은 수준을 보였으며(p<0.001), 엄격한 완전반응률을 포함한 완전반응률 이상의 반응률은 대조군(VMP) 대비 유의하게 높았다 (42.6% vs 24.4% P<0.001). 임상기간 동안 다잘렉스®주 병용 투여군에서 주입관련반응과 폐렴을 포함한 일부 감염이 나타났지만, 주요 이상 반응은 일반적인 화학 요법 치료와 비슷한 수준의 내약성을 보였다.
다잘렉스®주는 이전에 한 가지 이상 치료를 받은 다발골수종 환자를 대상으로 진행된 무작위 배정, 공개라벨, 3상 임상시험인 POLLUX(MMY3003)와 CASTOR(MMY3004)에서 각각 레날리도마이드 및 덱사메타손(Rd), 또는 보르테조밉 및 덱사메타손(Vd)과 병용 투여한 결과, 12개월 무진행생존기간이 대조군 대비 뚜렷한 향상을 보였으며 (83.2% vs 60.1%, 60.7% vs 26.9%) 질병진행 및 사망위험이 대조군 대비 각 임상시험에서 63% 및 61%감소한 것으로 나타났다(p<0.001).
또한, 다잘렉스®주가 추가된 병용투여군(DRd, DVd)이 기존 요법 대비 전체 반응률(92.9% vs. 76.4% p<0.001, 82.9% vs. 63.2%, p<0.001) 및 완전반응률과 엄격한완전반응률의 합계(43.1% vs. 19.2%, p<0.001, 19.2% vs. 9.0%, p=0.001) 모두 높았으며 매우 좋은 부분반응률 또는 매우 좋은 부분반응률을 포함한 더 높은 반응률에서도 깊은 반응을 보였다(75.8% vs. 44.2%, p<0.001, 59.2% vs: 29.1%, p<0.001).
두 임상시험에서 다잘렉스®주가 추가된 병용투여군은 대조군 대비 더 높은 빈도수로 주입관련반응이 보고되었으나 대부분 1-2 등급의 반응으로 첫 주입단계에서 나타났다. 또한 병용투여군에서 대조군 대비 더 높은 빈도수의 일부 혈액학적 이상반응이 보고되었으나, 3등급 이상의 감염 및 이상반응으로 인한 치료 중단률은 대조군과 비슷하게 나타났다.
제니 정 한국얀센 대표이사는 “이번 다잘렉스®주 적응증 확대로 병용치료가 필요한 다발골수종 환자들에게 치료 옵션을 제공할 수 있게 되어 기쁘다. 앞으로도 한국얀센은 다발골수종 환자들의 더 나은 치료 환경 조성을 위해 최선을 다할 것이다”고 전했다.
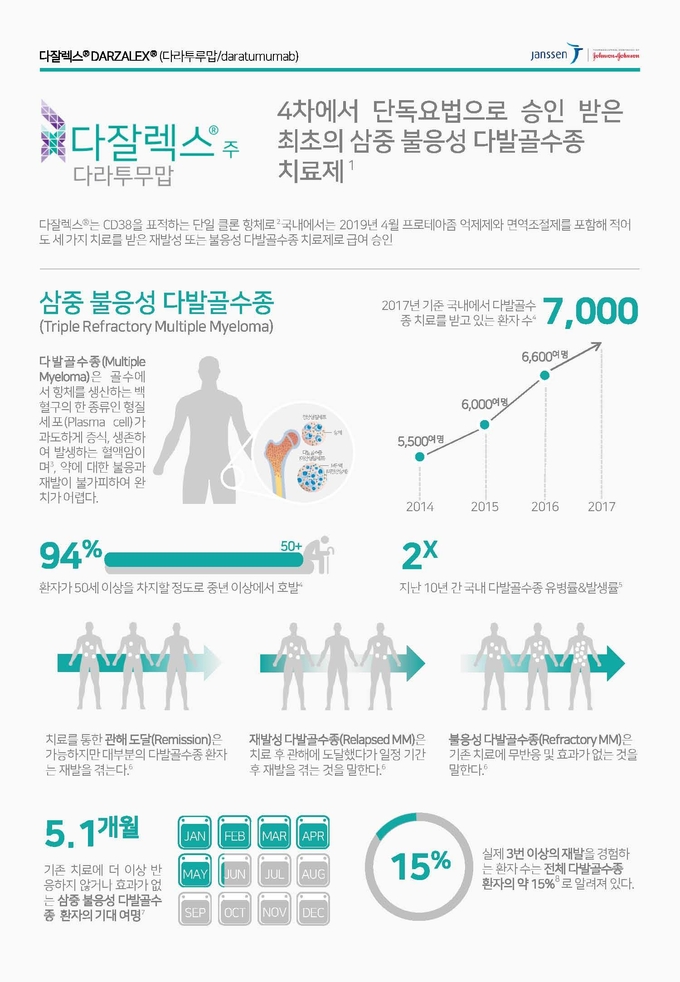
다발골수종은 골수에서 백혈구의 한 종류인 형질세포(Plasma Cell)가 비정상적으로 증식하는 난치성 혈액암으로, 국내에는 약 7,000여 명의 다발골수종 환자가 있다. 다잘렉스®주는 지난 2017년 11월 프로테아좀억제제와 면역조절제제를 포함해 적어도 세 가지 치료를 받은 재발 또는 불응성 다발골수종 환자를 위한 단독요법 치료제로 국내에서 허가 받은데 이어 2019년 4월 급여 인정받았다.
참조
ⅰ 엄격한완전반응률: Stringent Complete Response, sCR, sCR은 CR 기준을 만족시키고 혈청유리경쇄 비율의 정상화, 면역화학 혹은 면역형광법으로 골수조직 검사상 클론성 골수종 세포가 없는 경우로 정의한다.
ⅱ 완전반응률: Complete Response, CR,국제 다발골수종연구그룹(International Myeloma Working Group)에서 개발 한 5가지 치료 반응 범주 중 하나로, CR은 면역고정전기영동검사로 혈청과 소변에서 M 단백의 완전소실, 골수 내 형질세포가 5% 이하, 용해성병변이 진행되지 않고 연부조직의 골수종이 모두 소실되는 경우를 의미한다.
ⅲ 매우좋은부분반응률 : Very Good Partial Response, VGPR, VGPR은 혈청 M단백이 전기영동검사로는 검출되지 않으나 면역고정전기영동 검사 양성인 경우 혹은 90% 이상 감소한 경우 그리고 24시간 M 단백은 100 mg 이하로 감소한 경우를 뜻한다.
다발골수종 (Multiple Myeloma)
다발골수종은 골수에서 백혈구의 한종류인 형질세포(Plasma Cell)가 비정상적으로 증식하는 난치성혈액암으로,7 희귀난치성 질환으로 전체 암발생 비율에서 1%를 차지하며, 암으로 인한 사망비율에서는 약 2%를 차지한다.다발골수종은 재발을 반복하는 심각한 희귀난치성 혈액암으로 2018년 기준 전세계수는 160,000명, 사망자수는 106,000명이며,65세 이상의 남성에게서 더 높은 발병률을 보인다.
얀센(Janssen Pharmaceutical Companies of Johnson & Johnson)
얀센은 존슨앤드존슨 제약부문으로 질병이 과거의 일이 되는 미래를 만들어가고 있습니다. 얀센은 질병과 싸우는 과학, 치료를 개선하는 혁신, 절망을 치유하는 따뜻한 마음으로 전세계 환자들에게 건강한 미래를 선사하기 위해 끊임없이 노력하고 있습니다.
우리는 가장 커다란 변화를 만들 수 있는 의학분야로 심혈관과 신진대사, 면역, 전염병 및 백신, 신경과학, 종양학, 폐동맥고혈압 등에 집중하고 있습니다.
자세한 내용은 얀센 홈페이지 (www.janssen.com)에서 확인할 수 있으며, 공식 트위터계정(www.twitter.com/JanssenGlobal)을 통해 다양한 소식을 받아볼 수 있습니다.
References
2 DARZALEX® (daratumumab) EU summary of product characteristics. Janssen-Cilag International NV, Beerse, Belgium, 2016
3 US Food and Drug Administration. FDA approves Darzalex for patients with previously treated multiple myeloma. Press release. November 16, 2015
4 Dimopoulos, et al. Daratumumab, Lenalidomide, and Dexamethasone for Multiple Myeloma. N Engl J Med 2016; 375:1319-1331.
5 Palumbo, et al. Daratumumab, Bortezomib, and Dexamethasone for Multiple Myeloma. N Engl J Med 2016; 375:754-766.
6 Myeloma Patients Europe – What is multiple myeloma?
7 보건의료빅데이터개방시스템_질병소분류(3단상병)통계_성별/연령5세구간별현황(심사년도)