폐경 전/후 환자 모두에서 위약군 대비 약 2배 이상 연장된 무진행 생존기간 중간값이 확인된 입랜스 병용요법,[3] 국내 젊은 전이성 유방암 환자 삶의 질 개선에 기여
한국화이자제약(대표이사 사장 오동욱)은 7월 18일 플라자호텔에서 입랜스 (IBRANCE®, 성분명 팔보시클립) 국내 허가 3주년을 맞아 미디어 세션을 개최하고, 국내 유방암 환자의 발병 특성을 중심으로 젊은 유방암 환자 치료에서 입랜스의 가치를 공유하는 자리를 가졌다.
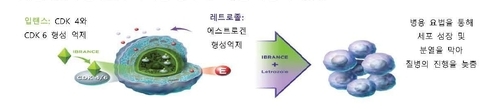
입랜스는 전체 유방암의 59.3%를 차지하지만(2015년 기준)[4] 치료 옵션이 제한적이었던 HR+/HER2- 유방암 분야에서 기존 단독요법 대비 약 2배 이상 개선된 무진행 생존기간 중간값(mPFS)으로 병용 효과를 확인하며[5] 새로운 패러다임을 연 전이성 유방암 치료제다.
암세포의 분화 촉진에 관여하는 사이클린 의존성 인산화효소(CDK) 4와 6을 억제하는 기전 계열 약제로는 입랜스가 최초(First-in class)[6]다.
이번 세션 연자로 초청된 국립암센터 유방암센터장 이근석 교수는 ‘전이성 유방암의 이해 및 젊은 유방암 환자의 의학적 미충족 수요’를 주제로 우리나라 유방암 환자의 발병 특성과 더불어 해외와 두드러지게 차이를 보이는 폐경 전 유방암 환자의 치료 환경에 대해 소개했다.
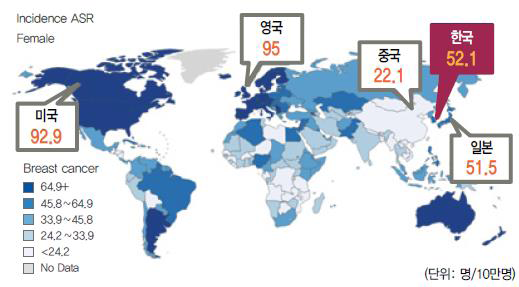
한국 유방암 기초 사실 통계 자료(2012년)에 따르면, 국내 유방암 주 발병 연령은 40~50대로 폐경 전 환자가 절반에 달할 정도로2 환자 대부분이 젊은 층에 속해, 미국에서의 주 발병 연령인 65세 이상과[7] 비교하여 차이를 보였다. 특히 유방암 발병 나이가 어릴수록 종양이 크고 공격적인 경향이 강하여 상대적으로 암의 진행속도가 빠른 경향을 보여 재발 및 전이의 위험이 높다[8]고 알려져 있다.
이근석 교수는 “최근 CDK4/6 억제제의 개발로 치료 옵션이 제한적이었던 HR+/HER2- 전이성 유방암 치료 환경이 유의미하게 개선됐지만, 그중 국내 유방암의 다수를 차지하는 폐경 전의 젊은 환자들에게는 치료 접근성에 한계가 존재하는 상황”이라고 설명하였다.
이 교수는 “치료 가능한 옵션이 있음에도 불구하고 제한적인 환경에 놓여있는 젊은 전이성 유방암 환자의 의학적 미충족 수요를 해결하기 위한 변화가 필요하다”고 지적했다.
이어서 한국화이자제약 의학부 이지선 이사는 ‘젊은 유방암 환자에 있어서의 입랜스의 가치’를 주제로 주요 임상 연구 결과를 통한 입랜스의 임상적 유용성에 대해 소개했다.
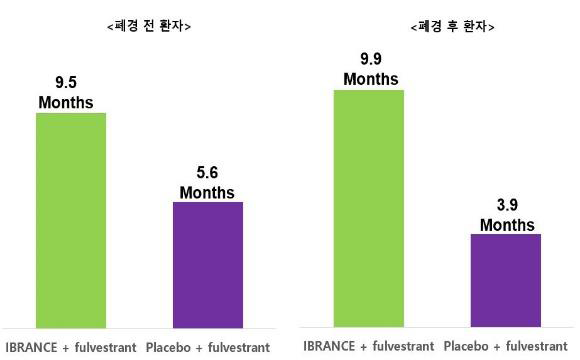
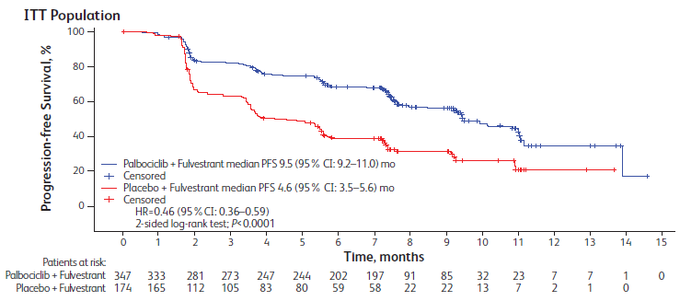
HR+/HER2- 전이성 유방암 환자 대상으로 진행된 임상 PALOMA-3 에서 입랜스-풀베스트란트 병용요법군의 무진행 생존기간 중간값(mPFS)이 9.5개월, 위약-풀베스트란트군이 4.6개월로 확인되었으며,3 폐경 전/폐경 후 환자에서 각 9.5개월(HR=0.50; 95% CI 0.29-0.87, two-sided p<0.013) 및 9.9개월(HR=0.45; 95% CI 0.34-0.59, two-sided p<0.0001), 위약군에서 각 5.6개월, 3.9개월로 나타나 폐경 전/폐경 후 환자 모두에서 입랜스 병용군의 mPFS가 비교군 대비 약 2배 이상 연장된 것으로 확인됐다.3 PALOMA-3 임상 전체 생존기간(OS) 세부 데이터 연구의 무진행 생존기간 후속분석에 따르면 입랜스 병용군의 mPFS는 11.2개월, 위약군은 4.6개월로 나타났다.[9]
또한, 환자 증상 보고 결과(PRO)를 활용한 QoL 분석에서 입랜스 병용요법은 위약군 대비 global QoL 점수가 통계적으로 유의미하게 높았으며(66.1 95% CI 64.5-67.7 vs 63.0 95% CI 60.6-65.3, p=0.0313), QoL 악화를 유의미하게 지연시켰다(HR=0.641; 95% CI 0.451-0.910, one-sided p=0.0065).[10] 통증 증상이 악화될 때까지의 기간(중간값)은 입랜스 병용군 8개월(95% CI 5.6–NE), 위약군 병용군 2.8개월(95% CI 2.3-5.4)을 기록, 입랜스 병용요법이 위약군에 비해 통증 증상이 악화될 때까지의 기간을 유의미하게 지연시키는 것으로 나타났다(HR=0.642; 95% CI 0.487-0.846, p<0.001).10
한국화이자제약 의학부 이지선 이사는 “입랜스는 기존요법 대비 무진행 생존기간을 개선함과 동시에, 전이성 유방암 환자들의 삶의 질 개선에 기여하며, 치료 과정에서 신체적, 심리적 어려움을 겪고 있는 전이성 유방암 환자들에 유의미한 치료 옵션”이라고 설명하며 입랜스가 하루에 한번 복용하는 경구제로서의 복용 편의성이 있다는 점에 대해서도 강조했다.
이 이사는 “현재 국내 폐경 전 환자에서 입랜스와 치료적 위치가 동등한 제품이 없는 상황에서 더 많은 환자들이 입랜스의 임상적 혜택을 경험할 수 있도록 지속적으로 노력할 것”이라고 밝혔다.
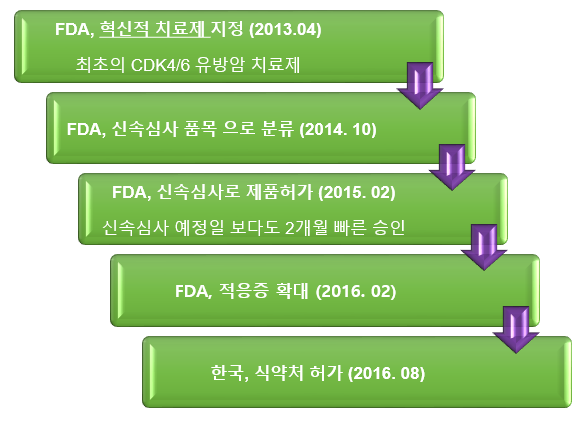
한편, 입랜스는 미국 FDA로부터 지난 2013년 4월 획기적 치료제(Breakthrough Therapy)로 지정,[11] 2015년 2월 레트로졸 병용요법 우선심사(Priority Review), 신속승인(Accelerated Approval)을 통해 제품을 허가 받았으며,[12] 국내에는 2016년 8월에 출시됐다.[13]
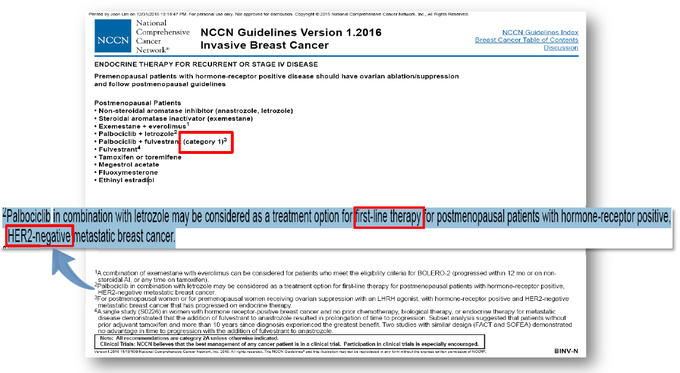
현재 미국종합암네트워크(National Comprehensive Cancer Network; NCCN) 및 유럽종양학회(ESMO, European Society for Medical Oncology)는 가이드라인을 통해 입랜스 병용요법을 폐경 전/폐경 후의 HR+/HER2- 전이성 유방암 환자 치료에서 category 1로 권고하고 있다.[14],[15]
한국화이자
한국화이자는 글로벌제약업계를 선도하는 화이자주식회사(Pfizer Inc.)의 한국법인으로, 2019년 5월 27일부터 Biopharmaceuticals Group 사업부문인 ‘한국화이자제약㈜’과 Upjohn 사업부문인 ‘한국화이자업존㈜’ 두법인으로 운영되고 있다.
Biopharmaceuticals Group 사업부문은 내과질환, 염증 및 면역질환, 희귀질환, 백신, 항암제, 병원사업부 등 6개 사업부에서 혁신적인 치료제를 환자들에게 제공하며 다양한 파이프라인을 연구/개발하고 있으며 Upjohn 사업부문은 심혈관계, 통증, 정신건강의학, 비뇨기질환, 안과질환 등 비전염성질환(NCD) 치료분야에서 주요 의약품치료제를 환자들에게 제공하고 있다.
한국화이자는 최고의 제품과 차별화된 서비스, 업계를 선도하는 프로그램을 통해 고객만족을 실현하고 있으며, 국민건강 증진과 국내의약업계 발전에 기여하고 있다. 글로벌임상시험유치∙R&D 전문가양성∙기술력및정보공유∙전략적제휴노력 등 다각적인 활동을 펼쳐 국내 R&D 및 보건의료산업 발전에 끊임없이 기여하고 있다. 또한 책임있는 기업 시민으로서 윤리경영, 지역사회 발전에 기여하기 위한 ‘조손가정행복만들기 캠페인’, ‘헬시에이징(Healthy Ageing) 캠페인’, ‘화이자의학상’ 등 다양한 사회공헌활동을 지속적으로 펼치고 있다. www.pfizer.co.kr
References
[1] 식품의약품안전처 온라인 의약도서관 의약품 상세정보 입랜스 75, 100, 125mg
[2] Kim Z, Min SY, Yoon CS, et al. The Basic Facts of Korean Breast Cancer in 2012: Results from a Nationwide Survey and Breast Cancer Registry Database. J Breast Cancer 2015; 18(2):103-11
[3] Loibl S, Turner N, Ro J, et al. Palbociclib Combined with Fulvestrant in PremenopausalWomen with Advanced Breast Cancer and Prior Progression on Endocrine Therapy: PALOMA-3 Results. The Oncologist 2017;22:1–11
[4] 건강보험심사평가원, 유방암 4차 적정성 평가 결과, May 2017
[5] Finn R, Crown J, Lang I. et al. The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomized phase 2 study, LANCET Oncology 2015; 16(1): 25-35.
[7] 한국유방암학회. 유방암백서 2017
[8] Youlden DR, Cramb SM, Dunn NA, et al. The descriptive epidemiology of female breast cancer: an international comparison of screening, incidence, survival and mortality. Cancer epidemiology 2012;36(3):237-48.
[9] Turner NC, André F, Cristofanilli M, et al. Overall Survival with Palbociclib and Fulvestrant in Advanced Breast Cancer. NEJM, 2018, DOI: 10.1056/NEJMoa1810527
[10] Harbeck N, Iyer S, Turner N, et al. Quality of Life With Palbociclib Plus Fulvestrant in Previously Treated Hormone
Receptor–Positive, HER2-Negative Metastatic Breast Cancer: Patient-Reported Outcomes From the PALOMA-3 Trial. Annals of Oncology Advance Access 2016 Mar 30.
[11] Key Milestones in the History & Development of Ibrance(palbociclib) in Breast Cancer, as of April 2016
[13] 입랜스 제품설명서(개정년월일 2019년 5월 31일)
[14] NCCN. NCCN Clinical Practice Guidelines in Oncology. Breast Cancer Version 4. 2018
[15] F. Cardoso, et al. Advanced Breast Cancer: 4th ESO–ESMO International Consensus Guidelines