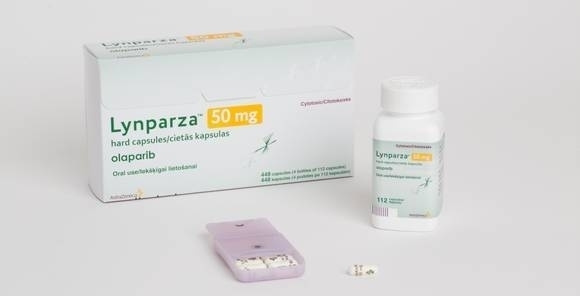
백금 민감성 재발성 BRCA 변이 고도장액성 난소암에 투여기간 제한 없도록
한국아스트라제네카(대표이사 사장 김상표)는 건강보험심사평가원 공고 개정에 따라 기존 15개월로 제한되어 있던 린파자(성분명: 올라파립)의 건강보험 급여투여 기간 제한이 삭제됐다고 밝혔다. 이로써, 2019년 5월 1일부로 린파자 치료를 요하는 18세 이상의 2차 이상의 백금기반 요법에 반응(CR 또는 PR) 백금민감성 재발성 BRCA 변이 고도 장액성 난소암 (난관암 또는 일차 복막암 포함) 환자들은 투여기간 제한 없이 건강보험 급여를 받을 수 있게 된다.
|
기존 공고 세부 인정사항
|
개정 공고 세부 인정 사항
|
|
18세 이상의 2차
이상의 백금기반 요법에 반응(CP 또는 PR) 백금민감성
재발성 BRCA 변이 고도 장액성 난소암 (난관암 또는
일차 복막암 포함)
ø 백금계 항암제 완료 후 8주 이내 투여하며 투여기간은 15개월까지 급여 인정함 (단, 질병 진행 시 투여 중단)
|
18세 이상의 2차
이상의 백금기반 요법에 반응(CP 또는 PR) 백금민감성
재발성 BRCA 변이 고도 장액성 난소암 (난관암 또는
일차 복막암 포함)
ø 백금계 항암제 완료후 8주 이내 투여
|
[2019년 4월 30일 고시된 요양급여의 적용기준 및 방법에 관한 세부사항 (건강보험심사평가원 공고 제2019-136호) 발췌]
린파자는 최초의 경구형 폴리중합효소 (PARP, Poly ADP-ribose Polymerase) 저해제로서, 종양세포의 DNA 손상에 대한 복구 기전을 저해하여 선택적으로 암세포의 사멸을 유도하는 기전을 가진다. 2015년 8월 5일, 식약처로부터 2차 이상의 백금기반요법에 반응(부분 또는 완전반응)한 백금민감성 재발성 BRCA 변이 고도 장액성 난소암(난관암 또는 일차 복막암 포함) 성인 환자의 단독 유지요법으로 국내 허가를 획득했다 .
대한부인종양학회 김승철 회장은 "린파자는 최초의 PARP 저해제이자 BRCA 유전자 변이가 있는 백금민감성 재발성 난소암 환자에서 사용이 허가된 약제로, NCCN 등 항암 치료 가이드라인에서 지정된 투여기간 없이 질환이 진행되기 전까지 치료를 지속하는 것을 권장하고 있다 ”며 “이번 건강보험 급여 확대에 따라 투여 기간의 제한 없이 환자들이 린파자 치료를 이어갈 수 있게 되어 의료진으로서 기쁘게 생각한다 "고 밝혔다.
한국아스트라제네카 항암제 사업부 김수연 상무는 “린파자를 필요로 하는 환자들이 치료에 어려움을 겪지 않도록 환자지원 프로그램 등 치료 접근성을 위해 지속적인 노력을 기울여 온 결과, 보험급여 투여 기간에 대한 걱정과 두려움 없이 치료를 지속할 수 있는 환경이 조성되어 기쁘게 생각한다”며 “BRCA 유전자 변이가 있는 백금민감성 재발성 난소암 환자에 대해 장기간의 유효성과 안전성 프로파일이 확인된 린파자가 앞으로도 계속해서 더 나은 치료 성과와 삶의 질에 기여할 수 있기를 희망한다”고 밝혔다.
* 린파자(olaparib)에 대하여
린파자TM(성분명: 올라파립)는 계열 최초의 경구형 폴리 ADP 리보스 폴리머레이스(poly ADP-ribose polymerase, PARP) 저해제다. 복구기전이 불완전한 종양세포 특성을 이용해 선택적으로 암세포의 사멸을 유도한다. 린파자는 유럽, 미국, 한국(식약처) 등 각국의 허가기관으로부터 BRCA 유전자 변이 동반 백금 민감성 재발성 난소암의 유지 치료제로 승인 받았다. 아스트라제네카는 린파자의 기타 PARP 의존성 종양에서 잠재력을 파악하기 위해 계속 연구를 진행하고 있다.
* 아스트라제네카(AstraZeneca)의 항암사업에 대하여
항암분야는 아스트라제네카가 뿌리깊은 전통을 가진 치료 분야이며, 아스트라제네카의 여섯 번째 성장 플랫폼이다. 아스트라제네카의 목표는 항암 치료의 패러다임을 재해석함으로써 환자를 돕고, 암으로 인한 사망을 뿌리뽑는 것으로, 향후 2020년까지 여섯 가지의 신규 항암 치료제를 환자들에게 선보일 계획이다. 아스트라제네카의 광범위한 차세대 약품 파이프라인은 난소암, 폐암, 유방암 및 혈액암의 4가지 질병에 초점을 맞추고 있으며, 해당 질병들은 면역항암제, 암의 유전적 요인과 내성, DNA 손상 복구 및 항체-약물 결합체 등 4가지 주요 기반을 바탕으로 표적되고 있다.
* 아스트라제네카(AstraZeneca) 소개
아스트라제네카는 100년 이상의 역사를 바탕으로 영국 런던에 본사를 둔 글로벌 바이오 제약 기업으로, 1913년과 1926년에 각각 설립된 스웨덴의 아스트라 에이비(Astra AB)와 영국의 제네카(Zeneca)사가 1998년 합병하여 탄생하였다. 과학적 혁신을 통해 환자의 삶을 변화시키는 것을 목표로 항암, 심혈관 대사 질환, 호흡기 질환의 세 가지 주요 치료 분야의 전문의약품을 연구 개발 및 공급하고 있으며, 이 외에도 염증 및 자가면역, 신경과학 등 분야의 연구를 활발히 진행하고 있다. 아스트라제네카는 전 세계 100여 개 지사와 3개의 전략적 R&D 센터를 운영하고 있으며, 약 6만여 명의 직원들이 “과학이 만들어 내는 가치(What Science Can Do)”라는 슬로건을 구현하기 위해 함께 노력하고 있다. 더 자세한 정보는 홈페이지 www.astrazeneca.com 및 트위터 계정 @AstraZeneca에서 확인할 수 있다.
References
1 .심평원, 요양급여의 적용기준 및 방법에 관한 세부사항 (건강보험심사평가원 공고 제2019-136호)
2 Rouleau M, et al. Nature Reviews. C;10(4), 293-301;
3 린파자 제품설명서(문헌개정연월일: 2017년 5월 17일)
5 2016 ESMO 가이드라인