질병 진행 후 후속 치료 과정에서도 유의하게 지속되는 개선효과 확인[1]
- 타그리소 1차 치료군, PFS2 를 비롯한 다양한 질병 진행 후 결과(Post-Progression Outcome) 분석에서 기존 표준요법 대비 우수한 지표 나타내 1
아스트라제네카의 표적항암제 타그리소가 국소진행성 또는 전이성 표피세포 성장인자 수용체(EGFR) 변이 비소세포폐암 환자의 1차 치료에 사용하여 질병이 진행된 이후에도 기존 표준요법 대비 지속적인 치료 이점을 보이는 것으로 나타났다.
이는 기존 글로벌 임상 3상 FLAURA 연구의 무진행생존기간(progression-free survival, PFS)과 전체생존율(overall survival, OS) 사이의 치료 성과를 확인하기 위한 탐색적 연구의 결과로, 지난 1월 18일 미국암연구학회(AACR, American Association for Cancer Research)가 발간한 학술지 클리니컬캔서리서치(Clinical Cancer Research)紙에 온라인 게재1됐다.
이번 연구는 이전에 치료를 받지 않은 EGFR 변이 국소진행성 또는 전이성 비소세포폐암 환자 556명을 대상으로2차 치료가 진행되기까지의 기간, 3차 치료가 진행되기까지의 기간, EGFR-TKI 치료 중단 혹은 사망까지의 기간, 그리고 PFS2 등 다양한 질병 진행 후 결과(Post-Progression Outcome)를 종합적으로 평가했다. 임상 참여 환자들은 타그리소 80mg 혹은 기존 EGFR-TKI 치료제(게피티닙 250mg 혹은 엘로티닙 150mg) 1일 1회 복용을 1:1 비율로 무작위 배정 받았다.
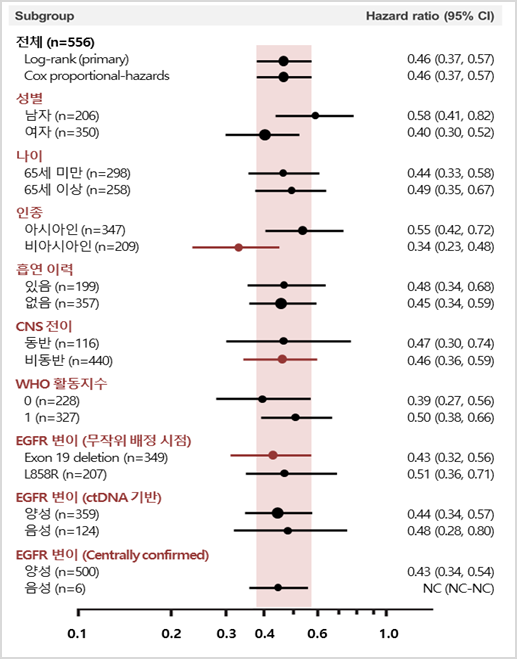
연구 결과, 1차 질병 진행 후 2차 치료를 지속한 환자들의 질병 진행 혹은 사망을 분석한 PFS2(2nd Progression Free Survival) 에 있어, 타그리소 1차 치료군은 두 번째 질병 진행 혹은 사망 위험을 대조군 대비 42% 감소시킨 것으로 나타났다(HR 0.58, 95% CI 0.44, 0.78, p<0.001). 데이터 확정시점 기준 타그리소 군은 중앙값에 도달하지 않았으며 (95% CI 23.7-NC), 대조군인 표준요법 치료군의 PFS2 중앙값은 20.0 개월 (95% CI 18.2-NC)이었다.
또한, 타그리소를 1 차 치료에 사용한 환자들은 기존EGFR-TKI를 1차에 사용한 경우와 비교하여 치료를 중단하거나 사망한 환자 수가 더 적었고(49 % vs. 77 %), 2차 치료로 진행되거나 사망에 이르기까지 걸린 시간의 중앙값이 23.5개월(95% CI, 22.0 – NC)로 대조군에 비해(13.8개월, 95% CI, 12.3-15.7; HR, 0.51; 95% CI, 0.40-0.64; P<0.0001) 9.7개월 긴 것으로 나타났다. 1
한편, 모든 경우의 EGFR표적치료제를 사용한 기간을 의미하는 TD-TKI혹은 사망(Time to Discontinuation of any EGFR-TKI or death) 은 타그리소 1차 치료군이 23.0개월(95% CI 19.5, NC), 기존 EGFR-TKI 사용 이후 타그리소를 2차로 사용한 경우를 포함한 기존 표준요법은 16.0개월(95% CI 14.8, 18.6)의 결과를 보였다.
삼성서울병원 혈액종양내과 안진석 교수는 “질병 진행 후 결과(PPO)는 항암 치료의 향방과 성과를 결정하는 1차 치료제의 선택에 참고가 되는 중요한 요인”이라며 “타그리소 1차치료의 임상적 혜택이 이후 차수 치료에도 긍정적인 영향을 미친다는 점을 고려할 때, 향후 전체 생존 개선에서도 긍정적인 결과가 기대된다. 유럽 식품의약국(EMA)은 PFS2를 전체생존(OS) 데이터의 대체적 평가지표로 고려하도록 권고[2]하고 있다”고 설명했다.
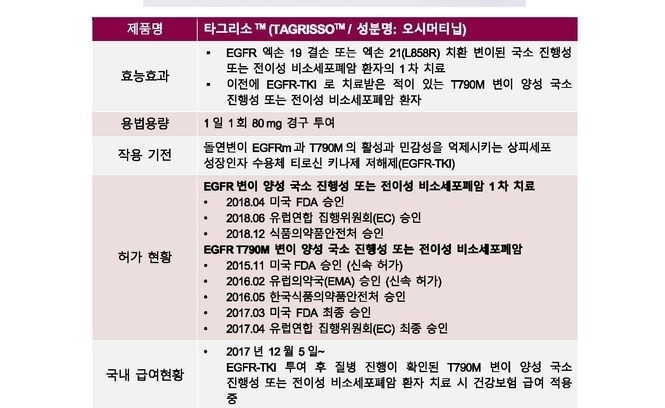
타그리소는 2018년 12월 26일 EGFR 엑손 19 결손 또는 엑손 21(L858R) 치환 변이된 국소진행성 또는 전이성 비소세포폐암 환자의 1차 치료에 대한 국내 적응증을 획득[3]하였으며, 미국 국가 종합 암 네트워크(NCCN, National Comprehensive Cancer Network)가 기존 치료 경험이 없는 EGFR 변이 양성 환자 1차 치료에서 가장 높은 등급인Category 1중에서도 유일한 선호요법(preferred)으로 권고[4]되고 있다.
* 타그리소(Tagrisso)에 대하여
타그리소TM(성분명: 오시머티닙)는 돌연변이 EGFRm과 T790M의 활성과 민감성을 억제시키는 상피세포성장인자수용체티로신키나제저해제(EGFR-TKI)다.
타그리소는 한국, 미국, 유럽 등 각국의 허가기관으로부터 EGFR 변이가 확인된 전이성 비소세포폐암, 그리고 국소진행성 또는 전이성 비소세포폐암에서 1차치료제로 승인받았다. 아스트라제네카는 폐암치료분야의 미충족 의학적요구를 해소하고 치료효과를 최대화할 수 있는 환자프로파일을 확인하기 위한 다양한 연구를 진행하 고있다.
* FLARUA 연구에 대하여
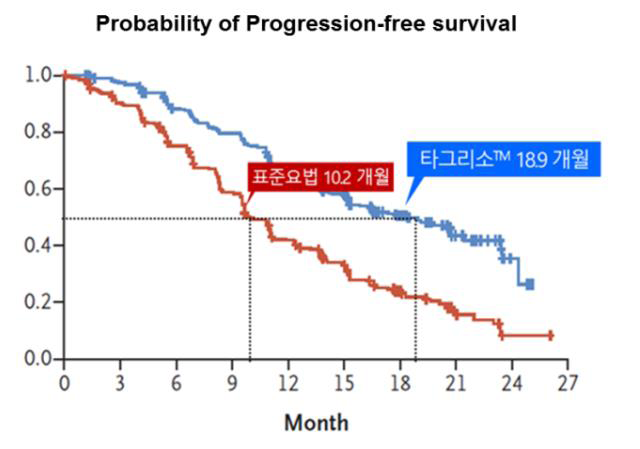
FLAURA 연구는 기존 치료경험이 없는 EGFR양성비소세포 폐암환자 556명을 대상으로 타그리소와 표준요법(게피티닙 또는 엘로티닙)의 효과를 비교한 3상 임상으로서 다국가, 무작위배정, 이중맹검, 1:1 대조디자인으로 진행이 되었다. Investigator assessment (2017년 6월 12일 data cut off 기준)에 의한 타그리소군의 무진행생존기간 중앙값(mPFS)은 18.9개월(95% CI 15.2-21.4)로, 표준요법치료군의 10.2개월(95% CI 9.6-11.1)에 비해 약 8.7개월의 유의한 연장효과를 나타냈으며, 표준요법치료군 대비 질병진행 또는 사망의 위험이 54% 감소된 것이 확인됐다(HR 0.46; 95% CI 0.37-0.57, P<0.001). 또한 전체생존률의 중간분석결과 (Data maturity 25%) 타그리소군에서 사망위험을 37% 감소시켰다. (HR 0.63; 95% CI 0.45-0.88, P<0.007, NS)
* 아스트라제네카(AstraZeneca)의 항암사업에 대하여
항암분야는 아스트라제네카가 뿌리깊은 전통을 가진 치료분야며, 아스트라제네카의 여섯번째 성장플랫폼이다. 아스트라제네카의 목표는 항암치료의 패러다임을 재해석함으로써 환자를 돕고, 암으로 인한 사망을 뿌리뽑는 것으로, 향후 2020년까지 여섯가지의 신규 항암치료제를 환자들에게 선보일 계획이다. 아스트라제네카의 광범위한 차세대약품 파이프라인은 난소암, 폐암, 유방암 및 혈액암의 4가지 질병에 초점을 맞추고 있으며, 해당 질병들은 면역항암제, 암의 유전적요인과 내성, DNA 손상복구 및 항체-약물결합체 등 4가지 주요 기반을 바탕으로 표적되고 있다.
* 아스트라제네카(AstraZeneca) 소개
아스트라제네카는 심혈관질환, 신진대사질환, 호흡기질환, 감염질환, 자가면역질환, 암, 전염병 및 신경과학질환 등의 치료제를 주로 발굴, 개발 및 상용화하는 글로벌 혁신주도의 바이오제약회사다. 아스트라제네카는 세계 100여국에서 사업을 추진하고 있고 전세계 수천만명의 환자들이 아스트라제네카의 혁신적인 의약품으로 치료받고 있다. 더 상세한 정보는 www.astrazeneca.com에서 확인할 수 있다.
References
[1] David Planchard, et al. Post-Progression Outcomes for Osimertinib versus Standard-of-Care EGFR-TKI in Patients with Previously Untreated EGFR3 Mutated Advanced Non-Small Cell Lung Cancer, January 18, 2019; DOI: 10.1158/1078-0432.CCR-18-3325
[4] Referenced with permission from the NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for NSCLC V.3.2019. © National Comprehensive Cancer Network, Inc. 2019. All rights reserved. Accessed February 14, 2019. To view the most recent and complete version of the guideline, go online to NCCN.org. NCCN makes no warranties of any kind whatsoever regarding their content, use or application and disclaims any responsibility for their application or use in any way.