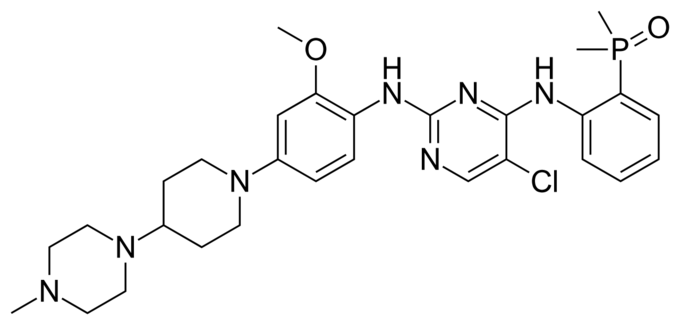
알룬브릭, 크리조티닙 치료 경험 있는 ALK 양성 전이성 비소세포폐암 환자에서 무진행 생존기간(PFS) 16.7개월 확인
한국다케다제약은 ALK 양성 비소세포폐암 치료제 알룬브릭®(브리가티닙)이 지난 11월 30일 식품의약품안전처로부터 허가를 받았다고 밝혔다.
알룬브릭은 이전에 크리조티닙으로 치료받은 적이 있는 역형성 림프종 인산화효소(Anaplastic Lymphoma Kinase, ALK) 양성 진행성 또는 전이성 비소세포폐암 환자를 위한 치료제다. 2017년 4월 미국식품의약국(FDA)의 신속 심사를 통해 허가를 받았고 , 2018년 11월 유럽연합 집행위원회(EC)의 승인을 받았다.
한국다케다제약 스페셜티케어 사업부 이지형 전무는 “알룬브릭은 크리조티닙 치료 실패 후 치료할 수 있는 ALK 양성 진행성 또는 전이성 비소세포폐암 치료제로서 무진행 생존기간 중앙값이 16.7 개월로 확인됐다”며, 1 이번 허가로 재발 또는 전이로 힘들어 하는 국내 ALK 양성 비소세포폐암 환자에게 효과적인 치료 옵션을 전달할 수 있게 돼 매우 기쁘다”고 말했다.
이번 시판 허가는 크리조티닙으로 치료한 후 질병이 진행된 국소 진행성 또는 전이성 ALK 양성 비소세포폐암 성인 환자 222명을 대상으로 진행된 알룬브릭의 공개형, 다기관 2상 연구인 ALTA 연구 결과에 의거해 이뤄졌다.
주요 유효성 결과 평가 척도는 독립심사위원회(IRC)가 평가한 객관적 반응률이었다. 임상 결과 권장 용량*으로 치료 받은 환자들의 객관적 반응률(ORR)이 53%, 반응 지속기간(DOR)은 15.7개월로 나타났다. (95% CI) 안전성 프로파일은 전반적으로 양호한 것으로 나타났다. 5
크리조티닙 치료 실패 후 알룬브릭으로 치료받은 환자군의 무진행 생존기간(PFS)의 중앙값은 16.7개월이다. 1
*권장 용량
처음 7일 동안 90mg을 1일 1회 경구투여 한 뒤 내약성이 좋은 경우 180mg 1일 1회로 증량
알룬브릭® (ALUNBRIG)에 대하여
알룬브릭은 다케다가 2017 년 2 월 인수한 아리아드 파마슈티컬스(ARIAD Pharmaceuticals, Inc.)가 개발한 표적 항암제다. 2017 년 4 월 알룬브릭은 크리조티닙에 내성이 생기거나 크리조티닙에 과민증이 있는 ALK 양성 전이성 NSCLC 환자의 치료와 관련해 미국 식품의약국(FDA)의 신속 승인을 받았다. 2018 년 7 월 캐나다 보건부(Health Canada)는 ALK 억제제(크리조티닙) 사용 후 질환이 진행됐거나 치료에 반응하지 않거나 또는 크리조티닙으로 치료되지 않는 ALK 양성 전이성 NSCLC 성인 환자 치료제로 알룬브릭을 승인했다. 미국 FDA 와 캐나다 보건부는 2상 임상시험인 ALTA(ALK 양성 비소세포폐암 치료를 위한 AP26113의 임상연구) 연구 결과를 바탕으로 알룬브릭을 승인했다.
알룬브릭은 크리조티닙에 내성이 있는 ALK 양성 NSCLC 환자 치료와 관련해 FDA에서 혁신치료제로 지정됐고, ALK, ROS1, EGFR (Epithelial Growth Factor Receptor)이 각각 변이된NSCLC의 치료와 관련하여 FDA에서 희귀의약품으로 지정됐다. 2018 년 11 월 유럽연합 집행위원회(EC)의 승인을 받았다.4
ALTA 임상연구에 대하여5
ALTA (ALK in Lung Cancer Trial of AP26113)는 크리조티닙 사용 후 질환이 국소적으로 진행되거나 전이된 ALK양성 NSCLC 성인 환자 222명을 대상으로 알룬브릭을 사용하여 두 환자군으로 분류하여 공개 라벨로 다기관에서 실시한 2상 임상연구다. 이 임상연구에서 환자들에게는 임상연구의 최초 7일간 알룬브릭 90mg을 1일 1회 투여한 후 알룬브릭 90mg(n=112) 또는 180mg(n=110)을 1일 1회 투여했다. 연구의 1차 목표는 RECIST v1.1 (고형종양평가기준)에 의거하여 연구자가 평가한 ORR (Objective Response Rate, 객관적반응률)이었으며, 2차 목표에는 IRC (Independent Review Committee, 독립평가위원회)에 의해 평가된 ORR, DOR (Duration of Response, 반응지속기간), 두개내(intracranial) ORR, 두개내 PFS (Progression free Survival, 무진행 생존), 안전성프로파일 및 내약성 등이 포함되었다.
역형성 림프종 인산화요소(ALK)양성 비소세포폐암에 대하여 6
세계보건기구(WHO)에 따르면 비소세포폐암(NSCLC)은 가장 흔한 형태의 폐암으로 매년 전세계적으로 새로 폐암을 진단받는 약 180만 명의 환자 중 약 85%가 NSCLC 환자다. 유전자 연구에서 ALK (Anaplastic Lymphoma Kinase, 역형성 림프종 인산화효소)의 염색체 재배열이 NSCLC 환자 중 일부의 주요 발병 원인이다. 전이성 NSCLC 환자의 약 3-5%에서 ALK 유전자 재배열을 확인할 수 있다. 다케다제약은 ALK 양성 NSCLC으로 해마다 새롭게 진단받는 전세계 환자 약 4만명의 삶을 향상시키기 위해 지속적으로 연구∙개발하는 데 최선을 다하고 있다.
다케다제약 (Takeda Pharmaceutical Company Limited)
다케다제약은 연구개발 중심의 글로벌 제약기업으로, 의약품 혁신을 통해 환자들의 건강을 증진하고 더 나은 세상을 만들어 가기 위해 헌신하고 있다. 특히 항암제, 위장관질환, 중추신경계, 백신 치료 분야에서 연구를 집중하고 있다. 또, 다케다제약은 혁신을 위해 내부뿐 아니라 파트너와 협업하며 R&D 연구를 실시하고 있으며, 신흥시장에서의 비즈니스와 위장관 질환과 항암제 분야 혁신적인 신약들을 통해 전세계에서 매출 성장을 지속해 나가고 있다. 전세계 70개국 이상에서 약 30,000명의 직원들이 각 국의 파트너와 긴밀하게 협력하며 환자들의 삶의 질 향상에 기여해 오고 있다. 더 자세한 정보는
http://www.takeda.com/news에서 찾을 수 있다.
한국다케다제약 ㈜
한국다케다제약은 환자들의 건강 증진을 최우선 가치로 두고 있다. 2011년 4월 서울에 설립된 이후, 싱가폴에 위치한 다케다제약(아시아 태평양지사)의 한국 내 마케팅 및 영업을 총괄하고 있다. 기업이념인 성실(Integrity)과 강력한 윤리적 기준을 바탕으로 의약품 및 관련 정보를 제공하고 있다.
References
1 DR Camidge et al. Brigatinib versus Crizotinib in ALK-Positive Non–Small-Cell Lung Cancer N Engl J Med 2018; 379:2027-2039
3 FDA approval letter, FDA, Apr 28, 2017
Accesed on Nov. 28, 2018
5 Kim D et al., Brigatinib in Patients With Crizotinib-Refractory Anaplastic Lymphoma Kinase–Positive Non–Small-Cell Lung Cancer: A Randomized, Multicenter Phase II Trial, Journal of Clinical Oncology 2017; 35: 2490-2498
6 Press release issued by Takeda to Present Positive Data from ALUNBRIG® (brigatinib) ALTA-1L Trial Showing a Reduction in Risk of Disease Progression or Death of More Than 50 Percent Versus Crizotinib in First-Line Advanced ALK+ NSCLC available at: https://www.takeda.com/newsroom/newsreleases accessed on Nov. 22 2018