• ‘라로트렉티닙‘, 다양한 암종에 적응증을 가진 첫 유전자 표적 항암제로 미 FDA 승인
• 암종 불문 성인 및 소아 환자에서 객관적 반응률(ORR) 75% 달성 [완전 반응(CR) 22%, 부분 반응(PR) 53%]
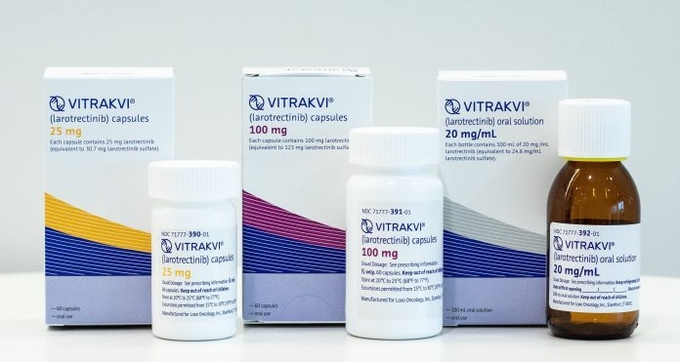
유전자 표적 항암치료제인 경구용 TRK 억제제 ‘라로트렉티닙(미국 내 상품명 비트락비Ⓡ)‘이 지난 11월 27일 미국 식품의약국(FDA)으로부터 시판허가를 받았다.
최초의 경구용 TRK 억제제인 ‘라로트렉티닙‘은 저항성 돌연변이가 없는 NTRK(neurotrophic receptor tyrosine kinase)유전자 융합을 가지고 있고, 대체할 만한 치료법이 없거나 이미 다른 치료에도 불구하고 질병이 진행된 전이성 또는 절제 수술 시 이환율이 높을 것으로 예상되는 성인 및 소아 고형암 환자의 치료제로 승인되었다.
이 적응증은 객관적 반응률(ORR:overall response rate)과 반응 지속기간(DOR: duration of response)을 토대로 신속 승인됐으며, 승인 상태가 유지되기 위해서는 향후 확증적 임상시험에서 임상적 이점이 입증되어야 한다.
이번 FDA 허가는 NTRK 유전자 융합을 가진 성인 및 소아 고형암 환자들을 대상으로 한 임상시험(성인을 대상으로 한 1상 시험, NAVIGATE 2상 시험 및 소아를 대상으로 한 SCOUT 1/2상 시험)에 근거한다. 이들 임상시험의 종합적인 연구 결과(pooled study result)에 따르면 ‘라로트렉티닙‘은 연부조직육종, 영아 섬유육종, 침샘암, 갑상샘암, 폐암, 흑색종, 결장암, 위장관기질종양, 담관암, 맹장암, 유방암 및 췌장암 등 다양한 암종에 대해 객관적 반응률(ORR) 75%(N=55) (95% CI: 61, 85%)와, 완전 반응률(CR) 22%를 달성했다.
TRK 억제제 ‘라로트렉티닙‘은 종양세포주에서 세포의 증식과 생존을 촉진해 발암인자 역할을 하는 변이성 TRK 융합단백질을 억제시키는 기전으로 작용한다. 차세대 염기서열분석(NGS) 및 형광동소혼성화(FISH) 진단 등에 따라 NTRK 유전자 융합을 가진 고형암 환자에게 사용할 수 있으며, 경구용 캡슐과 액체 두 제형으로 출시돼 복용 편의성을 높였다.
‘라로트렉티닙‘의 주요 임상시험 연구자이자 메모리얼 슬로언 케터링 암센터(MSKCC)의 신약 개발 서비스 책임자인 데이비드 하이먼 의학박사는 “이번 미 FDA의 승인은 희귀한 발암인자인 NTRK 유전자 융합을 가진 고형암 환자를 치료하는 데에 중요한 이정표를 세웠다“며 “‘라로트렉티닙‘은 이들 환자에 대해 환자의 연령이나 암종에 관계없이 임상적으로 의미있는 반응률을 달성함으로써 첫 TRK 억제제로 허가를 받았다“고 말했다.
바이엘 항암 전략사업부 책임자이자 제약사업부 집행위원회 위원인 로버트 라카제는 “TRK의 융합은 드물지만 많은 유형의 암종에서 발생하는데, 이러한 NTRK 유전자 융합을 보유한 진행성 고형암 환자를 위한 치료제로 ‘라로트렉티닙‘을 개발했다“며 “바이엘은 환자와 의사에게 가치를 제공하며, 정밀의학 시대를 맞이하여 암 치료의 새로운 미래를 앞당기기 위한 약속을 이행하기 위해 꾸준히 노력하고 있다“고 밝혔다.
한편, ‘라로트렉티닙‘은 심각한 상태에 있는 환자의 치료 안전성과 유효성을 크게 향상시킬 수 있는 의약품에 대해 미 FDA가 시행하는 ‘우선검토(Priority Review)‘ 절차를 통해 혁신치료제(Breakthrough Therapy)로 지정, 소아 희귀질환(Rare Pediatric Disease) 및 희귀의약품(Orphan Drug)으로 지정되었다. 바이엘은 2018년 8월 ‘라로트렉티닙‘에 대한 판매승인신청서(MAA)를 유럽에 제출했으며 다른 국가에서도 추가서류 제출을 진행 중이다.
TRK 융합 종양에 대하여
TRK 융합 종양은 NTRK 유전자가 연관성이 없는 다른 유전자와 융합되어 변이된 TRK 단백질을 생성할 때 발생하게 된다. TRK 융합 단백질 이라고도 불리는 변이된 단백질은 구성적으로 활성화 또는 과발현 되어 연쇄적인 신호전달(signaling cascade)을 유발한다. TRK 융합 단백질은 세포의 성장과 생장을 촉진하는 발암 역할을 하며, 특정 세포에 국한되어 있지 않고 신체의 어느 부위에서든 종양을 유발할 수 있다. TRK 융합 종양은 여러 종류의 성인 또는 소아 고형암에서 다양한 빈도로 발생 가능하며, 폐암, 갑상샘암, 소화기암(결장, 담관, 췌장 및 맹장), 육종, CNS암(신경교종 및 교모세포종), 타액선암(분비성 유방암과 유사한 침샘 암종) 및 소아암(유아 섬유육종 및 연부조직육종) 등을 포함한다.
‘라로트렉티닙‘ 관련 임상시험에 대하여
‘라로트렉티닙’의 이번 FDA 승인은 성인을 대상으로 한 1상 시험, NAVIGATE 2상 시험 및 소아를 대상으로 한 SCOUT 1/2상 시험에서 수집한 데이터(N=55)를 기반으로 한다. 독립 평가변수 심사위원회(IRC)가 검토한 종합적인 연구 결과에 따르면, ‘라로트렉티닙‘은 연부조직육종, 침샘암, 영아 섬유육종, 갑상샘암, 폐암, 흑색종, 결장암, 위장관기질종양, 담관암, 맹장암, 유방암 및 췌장암 등 다양한 암종에 대해 객관적 반응률(ORR) 75%(95% CI: 61, 85%)와, 완전 반응률(CR) 22%, 부분 반응률(PR) 53%를 달성했다. 반응까지의 시간 중앙값(Median time to response)은 1.84개월, 반응지속기간(DOR)이 6개월 이상인 비율은 전체 반응 환자의 73%(N=41명)으로 나타났으며, 분석 기간 중 반응지속기간 중앙값(Median DOR) (range 1.6+, 33.2+)과 무진행생존율(PFS)에는 도달하지 못했다.
‘NTRK 유전자 융합‘과 관계 없이 모든 환자가 포함된 안전성 관련 자료(N = 176)에서 10 % 또는 그 이상의 환자에서 보고 된 흔한 이상사례는 1 등급 또는 2 등급 이었다. 등급에 관계 없이 20% 이상의 환자에서 목격 되었던 이상사례는 ALT 증가(45%), AST 증가(45%), 빈혈 (42%), 피로(37%), 메스꺼움(29%), 어지러움(28%), 기침(26%), 구토(26%), 변비(23%), 설사 (22%) 였다.
‘라로트렉티닙(larotrectinib)’에 대하여
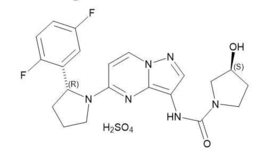
‘라로트렉티닙’은 NTRK 유전자 융합을 가진 암 환자들의 치료를 위한 경구용 TRK 억제제다. 관련 연구에 따르면 NTRK 유전자가 다른 유전자와 비정상적으로 융합되면 신체의 다양한 부위에서 종양의 발생과 성장을 초래 할 수 있는 TRK 융합 단백질을 생산하는 것으로 나타났다.
2017년 11월, 바이엘과 록소온콜로지는 TRK 억제제인 ‘라로트렉티닙’과 LOXO-195의 개발 및 상업화를 위한 독점적인 글로벌 협력 관계를 체결하였다. 미국에서의 임상연구와 서류절차는 록소온콜로지가 주도하고, 미국외의 규제활동과 글로벌 상업 활동은 바이엘이 주도할 예정이다. 미국 내에서는 바이엘과 록소 온콜로지가 공동으로 제품을 홍보 할 계획이다.
‘라로트렉티닙’은 미국에서 FDA의 승인을 받았으며, 유럽의약청 또는 미국 외 다른 보건 당국의 승인은 아직 받지 않았다.