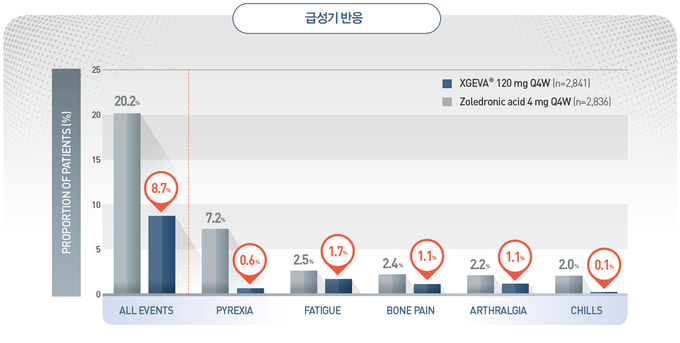
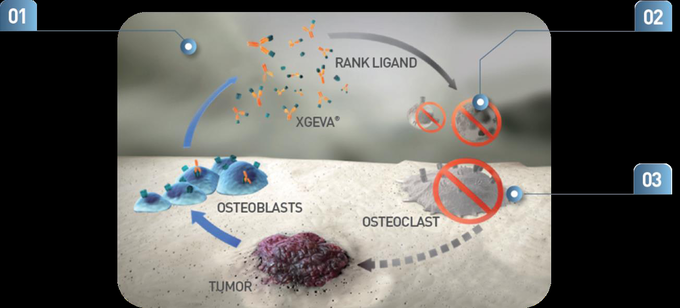
뼈를 파괴하는 파골세포에 필수적인 단백질(RANKL)과 결합해 골 파괴 악순환 멈추게 하는 엑스지바, 9월 1일부터 보험급여 적용1
암젠코리아(대표: 노상경)는 골전이 암환자의 골격계 합병증과 희귀질환 골거대세포종 치료제 엑스지바®(Xgeva®, 성분명: 데노수맙)가 보건복지부 고시에 따라 9월 1일부터 건강보험 약제 급여 목록에 등재됐다고 밝혔다.1
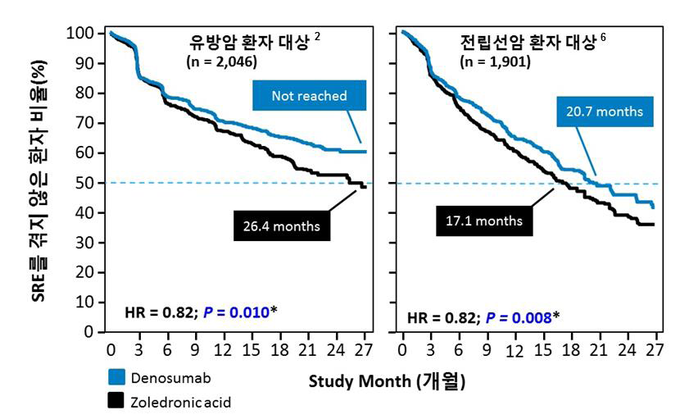
엑스지바는 골 전이 암 환자의 골격계 합병증 발생 위험을 감소시키는 유일한 표적 치료제다.
이 약은 뼈를 파괴하는 파골세포에 필수적인 단백질 RANKL(Receptor Activator of Nuclear factor Kappa-B ligand)과 결합하여, 파골세포의 형성, 기능, 생존을 억제해 골 파괴에 이르는 악순환을 멈추게 하는 기전을 가지고 있다.3
이번 고시에 따라 엑스지바는 ▲만 19세 이상 유방암, 전립선암 골전이 환자에서 골격계 증상(SRE, Skeletal-Related Events) 발생 위험 감소와 ▲절제가 불가능하거나 수술적 절제가 중증의 이환을 일으킬 수 있는 성인 및 골 성숙이 완료된 청소년의 골거대세포종 1차 이상 치료제로 보험 급여가 인정된다.1
단, 유방암과 전립선암 골전이 환자의 경우 단순 방사선 검사(plain X-ray) 상 용해(lytic) 소견을 보이는 경우, 또는 X-ray 상 정상이나 CT 또는 MRI로 골파괴가 명확히 입증된 경우에 급여가 인정되며, 뼈의 단층 촬영(bone scan)만으로 이상 소견이 확인된 경우는 인정하지 않는다.4
암젠코리아 노상경 대표는 “엑스지바의 보험급여 적용을 통해 효과적인 치료옵션의 접근성 향상을 기다렸던 유방암과 전립선암, 그리고 골거대세포종 환자들에게 좋은 소식을 전할 수 있게 돼 기쁘다”며 “암젠코리아는 앞으로도 환자를 위한다(To serve patients)라는 사명 아래 우리나라 환자들을 위해 혁신적인 치료 옵션을 제공하려는 노력을 이어나갈 것”이라고 강조했다.
◆ 유방암•전립선암 환자 약 70% 골전이 발생 , 엑스지바로 골격계 합병증 예방•치료 가능4
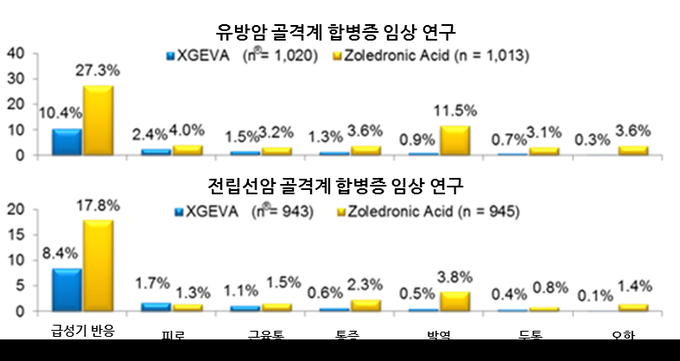
엑스지바는 고형암 중에서도 유방암•전립선암의 골 전이 환자에 있어 골격계 합병증의 예방과 치료에 보험급여가 적용된다.4,5
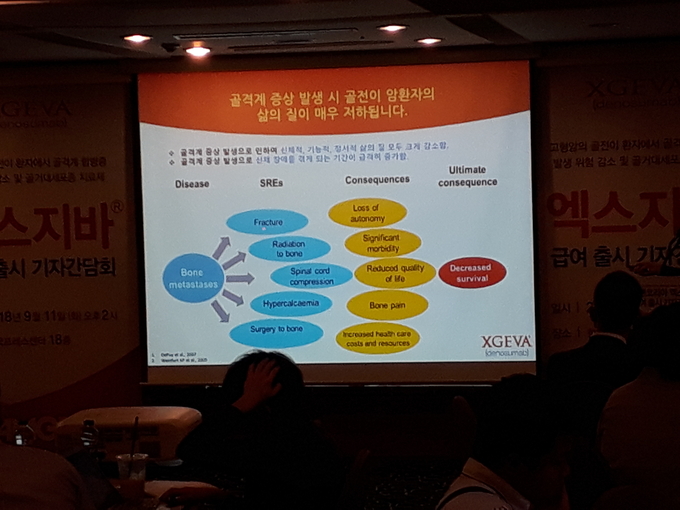
고형암이 뼈로 전이되면 ▲병리학적 골절 ▲뼈에 대한 방사선 조사 ▲척수압박 ▲뼈 수술 등과 같은 골격계 증상이 발생하는데 이로 인해 환자는 생명의 위협과 급격한 삶의 질 악화로 고통 받게 된다.5
특히 전립선암과 유방암은 고형암 중에서도 뼈 전이가 호발하는 질환으로, 전이율은 환자 10명 중 6~7명에 이르는 것으로 보고된 바 있다.5
삼성서울병원 혈액종양내과 안진석 교수는 “골전이가 발생한 암 환자의 경우 골격계 합병증 발생 위험이 매우 높기 때문에 해외에서는 골전이 즉시 예방•치료를 시작한다”며 “우리나라는 아직 골격계 합병증 치료율이 낮은 편으로, 특히 질환 위험이 높은 유방암•전립선암 환자는 골격계 합병증에 대한 인식을 높이고 골 전이 즉시 예방, 치료할 수 있는 환경이 마련돼야 한다”고 강조했다.
미국종합암네트워크(NCCN) 가이드라인은 유방암과 전립선암이 뼈전이된 환자에게 엑스지바를 category-1으로 권고하고 있다.
◆ 그동안 치료 옵션이 제한되었던 수술 불가능한 골거대세포종 환자 급여 혜택 가능1,4,9
엑스지바는 수술이 불가능한 골거대세포종 환자를 대상으로도 급여가 적용된다.1,4 희귀질환인 골거대세포종은 국소적으로 나타나는 파골세포성 기질종양으로, 뼈 통증, 관절 기능 저하, 골절, 신경 결손 등을 유발한다. 골거대세포종은 대부분 외과적 절제술로 치료하지만 장애 및 합병증 위험으로 수술이 불가능한 경우 선택할 수 있는 치료 옵션이 많지 않았다.9
암젠코리아 의학부 김수아 전무는 “골거대세포종은 100만 명 당 1명에게 발병하는 극희귀질환으로 양성 종양이지만 재발이 빈번하고 극심한 통증과 뼈, 관절 변형을 야기한다”며 “종양의 부위, 크기, 인접 신경에 따라 수술이 어려운 환자들의 경우 급여 적용을 받을 수 있는 치료제가 제한적이었다”고 설명했다.
엑스지바는 수술 불가능한 골거대세포종 1차 이상 환자를 대상으로 진행한 세 건의 2상 임상연구에서 최소 72%에서 최대 88%의 종양 반응률을 확인했다.9 또한, 질병 진행의 지연과 함께 환자의 통증 감소, 관절의 기능 및 운동능력 향상과 같은 임상적 유용성이 확인됐다.9
엑스지바(Xgeva)에 대하여
엑스지바(성분명: 데노수맙)은 파골세포의 형성, 기능, 생존에 필수적인 단백질인 RANKL과 결합해 골흡수를 억제함으로써 손상된 골조직의 회복과 개조를 촉진한다.
이 같은 기전으로 엑스지바는 유방암•전립선암 등 고형암의 골전이 환자에서 골격계 증상의 발생 위험을 감소시키고, 성인 및 성숙이 완료된 청소년에서 절제가 불가능하거나 수술적 절제가 중증의 이환을 일으킬 가능성이 있는 골거대세포종을 치료한다.
암젠(Amgen)에 대하여
암젠은 혁신 치료제를 발견, 개발, 제작 및 공급함으로써 심각한 질환으로 고통 받고 있는 환자들을 위해 생물학적 가능성을 개발하는데 헌신하고 있다. 이러한 헌신은 질병의 복잡성을 타파하고 인간 생물학의 기초를 이해하기 위해 진보된 인간 유전학과 같은 도구를 사용하는 것에서 시작한다.
암젠은 많은 의학적 미충족 니즈가 있는 분야에 집중하며 암젠의 전문성을 발휘하여 치료 결과를 개선하고 환자들의 삶을 극적으로 개선하고 있다. 1980년부터 바이오기술의 선구자로 자리잡은 암젠은 독립적인 바이오테크 회사들의 글로벌 리더로 성장하였으며 전 세계 수백 만 명의 환자들과 만나고 파격적인 가능성을 지닌 치료제 파이프라인을 개발하고 있다.
더 자세한 내용은 www.amgen.com에서 확인할 수 있다.
암젠코리아(Amgen Korea)에 대하여
암젠은 골질환, 심혈관질환, 혈액종양/암, 신장질환, 염증질환, 뇌과학, 바이오시밀러 치료제 등을 포함하는 자사의 임상 파이프라인을 발전시키고 중증질환으로 고통 받고 있는 국내 환자들에게 혁신적인 치료제를 공급하기 위해 2015년 11월 암젠코리아를 설립하였다. 앞으로도 암젠코리아는 생명공학 분야의 일원으로, 다양하고 적극적인 활동을 전개하여 국내 제약 산업 발전에 기여할 예정이다.
References
1 보건복지부 고시 제2018-177호, 약제 급여 목록 및 급여 상한금액표 일부개정, Released on 2018-08-27
2 Xgeva MFDS Label
3 Xgeva FDA Prescribing information
4 건강보함심사평가원 공고 제2018-210호, 암환자에게 처방투여하는 약제에 대한 요양급여의 적용기준 및 방법에 관한 세부사항, Released on 2018-08-30
5 뼈전이가 있는 암환자에서 비스포스포네이트 사용과 뼈 건강, NHIS Ilsan Hospital, 2016
6 Stopeck, Alison T., et al. Denosumab compared with zoledronic acid for the treatment of bone metastases in patients with advanced breast cancer: a randomized, double-blind study. Journal of Clinical Oncology 28.35 (2010): 5132-5139.
7 NCCN Clinical Practice Guidelines in Oncology: Breast Cancer, Version 2.2017
8 NCCN Clinical Practice Guidelines in Oncology: Prostate Cancer, Version 2.2017
9 David Thomas , et al. Denosumab in patients with giant-cell tumour of bone: an open-label, phase 2 study, Lancet Oncol 2010; 11: 275–80