높은 내성 장벽, 적은 부작용, 우월한 바이러스 억제 효과를 모두 갖춘 획기적 HIV 치료제2,3,4,5
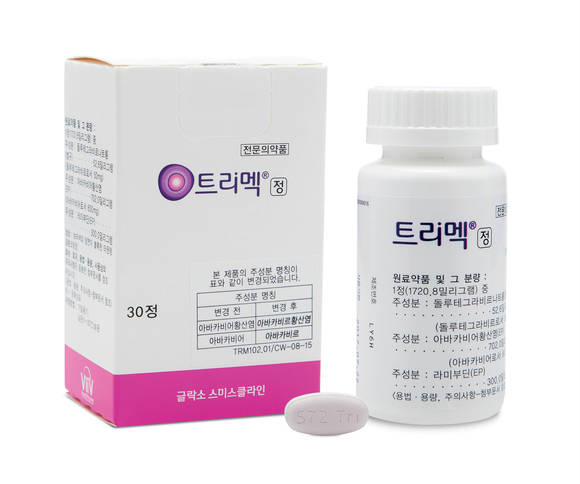
GSK(한국법인 사장 홍유석)는 돌루테그라비르를 포함한 최초의 단일정 복합 HIV 치료제 ‘트리멕(돌루테그라비르 50mg, 아바카비르 600mg, 라미부딘 300mg)’을 11월 1일부터 국내 급여 출시한다고 밝혔다. 식사와 관계없이 1일 1정 복용하는 트리멕은 지난 6월 9일 식품의약품안전처로부터 '40kg 이상의 12세 이상 청소년 및 성인 HIV 감염 치료제'로 허가 받았다.
트리멕은 비브 헬스케어(ViiV Healthcare)의 돌루테그라비르와 아바카비르/라미부딘을 결합한 첫 번째 단일정 복합제다. HIV가 숙주 세포에 침투하기 위해서는 RNA를 DNA로 바꾸는 복제 과정과 바이러스 DNA가 숙주 세포 DNA의 일부가 되는 통합 과정을 거쳐야 하는데, 뉴클레오시드 역전사효소 억제제(NRTIs)와 인테그라제 억제제(INSTI)는 이 두 가지 과정에 필수적인 효소의 작용을 억제함으로써 바이러스의 복제와 추가적인 세포 감염을 막는다. 1 트리멕은 INSTI인 돌루테그라비르와 NRTIs인 아바카비르/라미부딘으로 구성되어 있어 단 한 개의 알약으로 항레트로바이러스 치료가 가능하다.1
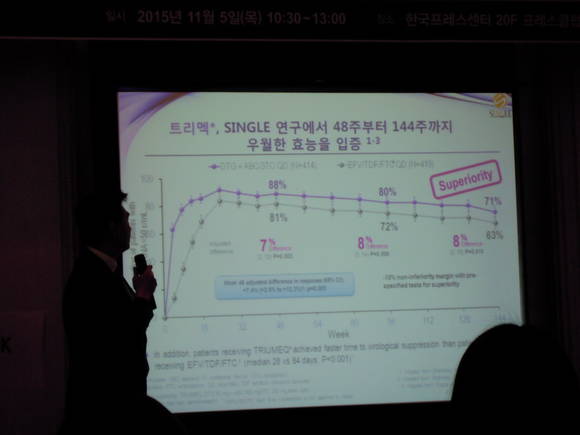
트리멕은 내성 장벽이 높은 돌루테그라비르를 기반으로 하고 있어 장기 복용에도 안심하고 사용할 수 있고, 부작용이 적어 치료 중단율도 낮다.2,3,4,5 또한 트리멕은 3상 임상시험(SINGLE)을 통해 치료 경험이 없는 HIV 성인 환자에서 에파비렌즈/테노포비르/엠트리시타빈 복합제* 대비 우월한 바이러스 억제 효능을 입증한 바 있다.2 이 연구에 따르면, 48주까지의 결과를 비교했을 때 트리멕은 88%의 바이러스 억제율을 보인 반면 에파비렌즈/테노포비르/엠트리시타빈 복합제는 81%의 억제율을 보였다(HIV-1 RNA <50 copies/mL, P=0.003).2 또한 바이러스 억제율이 80%에 도달하는 시점도 트리멕은 28일로, 에파비렌즈/테노포비르/엠트리시타빈 복합제의 84일에 비해 훨씬 더 빨랐다(P<0.001). 2 트리멕의 우월한 바이러스 억제효과는 144주까지 지속되었다.6
돌루테그라비르 개발자인 日 시오노기제약 후지와라 타미오 박사는 “돌루테그라비르는 인테그라제에 아주 깊고 깔끔하게 결합하기 때문에 같은 INSTI 계열의 다른 제재들 보다 결합되어 있는 시간이 10배에서 30배 더 길다”며, “이러한 디자인적 특성 덕분에 바이러스 억제가 지속적으로 유지되어 내성이 쉽게 발현되지 않는 것으로 볼 수 있다”고 말했다.
GSK 홍유석 사장은 “GSK는 세계 최초로 HIV 치료제를 개발한 명실상부한 HIV 치료의 선두 주자로 HIV 감염인들의 삶의 질 향상을 위해 꾸준히 노력하고 있다”며, “이번 트리멕 출시를 통해 국내 HIV 감염인들에게 높은 내성 장벽과 적은 부작용, 식사 관계 없이 하루 한 알 복용하는 간편성을 모두 갖춘 트리멕을 새로운 치료 옵션으로 제공할 수 있게 되어 매우 기쁘다"고 말했다.
HIV(인체면역결핍바이러스)는 성관계, 수혈이나 혈액 제제를 통해 사람의 몸 안으로 들어와 면역세포인 CD4+T세포를 파괴시켜 AIDS(후천성면역결핍증)를 일으킨다. 7 HIV에 감염되었지만 일정한 면역수치(CD4+T세포 200/㎣ 이상)를 유지하면서 뚜렷한 증상이 없는 상태를 HIV 감염인이라 부르고, 감염 후 시간이 지나면서 면역체계가 파괴되어 CD4+T세포 수가 200/mm3이하로 감소하거나 AIDS라고 진단할 수 있는 특정한 질병, 또는 증상이 나타난 경우를 AIDS 환자라고 부른다.7 유엔 에이즈 전담기구인 UNAIDS에 따르면 2014년 기준 전 세계 HIV 감염인 수는 약 3,690만 명으로, 이 중 항레트로바이러스 치료를 받고 있는 사람들은 전체 감염인의 절반에도 미치지 못하는 1,500만 명에 불과하다. 8 우리나라의 경우 질병관리본부 통계에 따르면 2014년 기준 HIV 누적 감염인수는 11,504명이며, 이 중 2014년 신규 감염인수는 1,081명으로 20~40대 젊은 층이 전체의 72.7%를 차지하고 있다.9
현재까지 HIV를 완전히 제거할 수 있는 약은 없다. 일반적으로 HIV 감염인이 치료제를 복용하지 않으면 15년 후 약 75%가 AIDS 환자로 진행되지만, 최근 다양한 치료제의 개발로 일찍 발견하여 적극적으로 치료한다면 병의 진행을 장기간 막을 수 있게 되었다.7 HIV 조기 치료는 합병증을 줄여 HIV 감염인의 건강 유지에 효과적이며, 꾸준한 항바이러스제 복용으로 체액 속에 바이러스 농도가 감소되면 타인에 대한 감염력도 현저히 감소시킬 수 있다.7
SINGLE 연구 소개2
SINGLE은 항레트로바이러스 치료 경험이 없는 833명의 HIV-1 감염 환자들을 대상으로 하루 한 번 복용하는 트리멕(돌루테그라비르 50mg/아바카비르 600mg/라미부딘 300mg) 대 하루 한 알 복용하는 에파비렌즈 600mg/테노포비르 300mg/엠트리시타빈 200mg 복합제제를 96주간 비교 평가한 3상 무작위, 이중맹검, 이중위약, 다국가, 다기관, 병행설계 연구이다. 48주째에 트리멕 투여 그룹의 88%, 에파비렌즈/테노포비르/ 엠트리시타빈 투여 그룹의 81%가 바이러스학적 억제(HIV-1 RNA<50 copies/mL)를 달성하여 통계적으로 트리멕이 우월한 것으로 나타났으며(P=0.003), 트리멕 그룹이 바이러스학적 억제에 도달하는 데 걸린 평균 시간은 28일로 에파비렌즈 그룹의 84일에 비해 더 짧았다(P<0.001). 또한 48주째에 이상반응으로 인한 치료 중단율은 트리멕 그룹이 2%, 에파비렌즈 그룹이 10%로, 트리멕 그룹에서 적어도 중등도(2-4등급) 및 ≥2% 빈도로 나타난 이상반응은 설사(5%), 불면증(4%), 두통(3%) 등이었으며, 에파비렌즈 그룹의 경우 발진(5%), 어지러움(5%), 불면증(4%), 설사(4%), 메스꺼움(3%), 두통(3%) 등이었다.
SINGLE 연구 48주 결과, 트리멕 그룹에서 돌루테그라비르나 아바카비르, 라미부딘 약제에 대한 감수성을 감소시키는 유전자형 내성은 발견되지 않았다.
트리멕에 대하여
트리멕은 인테그라제 억제제인 돌루테그라비르와 뉴클레오시드 역전사효소 억제제인 아바카비르/라미부딘을 결합한 첫 번째 1일 1정 복합제다.
HIV의 생명주기 단계 중 핵심적인 두 단계는 바이러스가 복제한 RNA를 DNA로 바꾸는 복제 과정과 바이러스의 DNA가 숙주 세포 DNA의 일부가 되는 통합 과정이다. 이 두 과정은 뉴클레오시드 역전사효소와 인테그라제라는 두 가지 효소를 필요로 하는데, 뉴클레오시드 역전사효소 억제제와 인테그라제 억제제는 이들 효소의 작용을 억제함으로써 바이러스 복제와 추가적인 세포 감염을 막는다.1
트리멕은 2014년 8월 미국 FDA에 이어 2014년 9월 유럽 연합에서 40kg 이상의 12세 이상 청소년 및 성인에서 HIV 감염 치료제로 승인받았으며, 전 세계적으로 허가 신청이 진행되고 있다.
트리멕은 비브 헬스케어의 등록 상표다.
GSK에 대하여
GSK는 세계적인 연구개발 중심의 헬스케어 회사로서, 인류가 건강장수와 행복을 추구하며 왕성하게 활동할 수 있도록 인간의 삶의 질을 향상시키는 일에 헌신하고 있다. 회사에 관한 자세한 정보는 www.gsk-korea.co.kr에서 확인할 수 있다.
비브 헬스케어(ViiV Healthcare)에 대하여
비브 헬스케어는 글로벌 HIV 전문 회사로 2009년 11월 글락소스미스클라인과 화이자가 HIV 치료의 발전과 환자의 케어를 위해 설립하였다. 시오노기는 2012년 10월 10%의 지분을 취득하며 주주가 되었다. 비브 헬스케어는 HIV/AIDS에 대해 이전에 어떤 회사가 수행한 것보다 훨씬 더 깊고 폭넓은 관심을 가지고 효과적이며 새로운 HIV 치료제를 전달하기 위한 새로운 접근을 하며, HIV 관련 커뮤니티를 지원하는 것을 목표로 하고 있다. 비브 헬스케어에 대한 자세한 내용은 www.viivhealthcare.com에서 확인할 수 있다.
[참고자료]
1 GSK. Triumeq® (dolutegravir/abacavir/lamivudine) Product Backgrounder for Media. 2014.
2 Walmsley SL, Antela A, et al. Dolutegravir plus Abacavir–Lamivudine for the Treatment of HIV-1 Infection. N Engl J Med. 2013;369:1807-18
3 Clotet B, Feinberg J, et al. Once-daily dolutegravir versus darunavir plus ritonavir in antiretroviral-naive adults with HIV-1 infection (FLAMINGO): 48 week results from the randomised open-label phase 3b study. Lancet. 2014;383:2222-2231
4 Raffi F, Jaeger H, et al. Once-daily dolutegravir versus twice-daily raltegravir in antiretroviral-naive adults with HIV-1 infection (SPRING-2 study): 96 week results from a randomised, double-blind, non-inferiority trial. Lancet Infect Dis. 2013;13:927–935
5 Cahn P, Pozniak AL, et al. Dolutegravir versus raltegravir in antiretroviral-experienced,integrase-inhibitor-naive adults with HIV: week 48 results from the randomised, double-blind, non-inferiority SAILING study. Lancet. 2013;382:700–708
6 SINGLE 144_Walmsley S, et al. JAIDS
7 질병관리본부. HIV/AIDS 정보 [Online]. 2014. [Last accessed Mar 2015]
8 UNAIDS. Fact Sheet: 2014 Global Statistics [Online]. [Last accessed Aug 2015]
* 에파비렌즈/테노포비르/엠트리시타빈 복합제는 국내에서 허가 받지 않았습니다.