
나노코일의 생체내 원격제어 제어 시스템 개발
나노미터 수준 동적 제어로 맞춤형 임플란트 소재로의 발전 기대
고려대학교(총장 정진택) 신소재공학부 연구팀이 임플란트 소재 표면에서 실시간 원격으로 세포의 부착과 분화를 조절할 수 있는 생체내 나노코일 시스템을 개발했다.

이번 연구는 국제학술지 Advanced Materials(Impact Factor: 27.398)에 제1저자 민선홍 석박사통합과정생, 제1저자 고민준 석박사통합과정생, 교신저자 김영근 교수, 교신저자 강희민 교수 순으로 2월 3일(한국시간 기준) 게재됐다.

* 논문명 : Remote Control of Time-Regulated Stretching of Ligand-Presenting Nanocoils In Situ Regulates the Cyclic Adhesion and DIfferentiation of Stem Cells
줄기세포는 주변 환경을 감지하며 그 환경에 맞는 조직 세포로 분화할 수 있다. 이런 특성을 이용하여 뼈, 지방, 근육, 심근, 혈관, 연골 등 다양한 기관 조직 세포로 분화를 유도할 수 있어 재생 의학 및 공학 분야에서 주목받고 있다. 그러나 체내에서 줄기세포의 부착에 대한 조절뿐만 아니라 분화에 대한 조절이 원활하지 않다는 문제점이 있다.
* 줄기세포 : 상대적으로 미분화된 세포로 주변 환경에 따라 특정 세포로의 분화가 가능하기 때문에, 생체 재생, 인공 장기 형성, 세포 치료 등 환자 맞춤형 치료를 위한 핵심 세포로 각광받고 있음

연구팀은 전기도금을 이용하여 제작된 코발트-철 자성 나노코일을 활용하여 임플란트 소재 표면 위에서 외부 자기장으로 세포 부착성 RGD 리간드의 간격을 가역적으로 실시간 원격 조절할 수 있는 나노코일 시스템을 이용한 줄기세포의 부착 및 분화의 조절이 가능한 시스템을 개발했다.
* 코발트-철 자성 나노코일: 약 70 nm 두께의 나노선이 외경 180 nm, 총 길이 1 μm로 꼬인 나선형 구조로, 자기장을 걸면 신장하고, 자기장이 없으면 원래 길이로 수축하는 가역적인 특성을 갖는 나노구조
* RGD 리간드: 세포 부착을 매개하게 하는 세포외 기질(Extracellular Matrix)의 단백질 중 파이브로넥틴의 아미노산 서열. 세포막에 존재하는 수용체 인테그린(integrin)은 RGD 리간드를 인지하고 세포가 부착되도록 함
나노코일은 생체 내외에서 자기장을 이용하여 실시간 원격으로 RGD 리간드의 간격을 나노미터 수준으로 정밀하게 조절할 수 있도록 유도됐으며, 자기장에 의해 나노코일이 신장하여 RGD 리간드가 넓은 간격으로 제시될 때 줄기세포의 부착율과 골세포로의 분화율이 성공적으로 향상되는 것을 확인할 수 있었다.
환자의 상황에 맞추어 치료 시점을 원격으로 제어할 수 있는 나노코일 시스템의 개발로 임플란트 소재의 생체내 줄기세포의 정밀 제어 가능성을 검증한 데 의의가 있으며, 맞춤형 줄기세포 치료의 상용화 가능성을 제시했다.
이번 연구는 과학기술정보통신부·한국연구재단이 추진하는 신진 연구자지원사업 및 중견연구자지원사업의 지원으로 수행됐다.
주요내용 설명

<작성자 : 고려대학교 강희민, 김영근 교수>
[ 논문명, 저자정보 ]
논문명
Remote Control of Time-Regulated Stretching of Ligand-Presenting Nanocoils In Situ Regulates the Cyclic Adhesion and DIfferentiation of Stem Cells
저 자
강희민 교수 (교신저자/고려대학교), 김영근 교수(교신저자/고려대학교) 민선홍 (공동 제1저자, 고려대학교), 고민준 (공동 제1저자, 고려대학교), 정희준 박사 (공동 제1저자, Northwestern University), 김원식 (공동저자, 한국과학기술원), 한성범 (공동저자, 고려대학교), 김유리 (공동저자, 고려대학교), 배건휴 (공동저자, 고려대학교), 이성규 (공동저자, 고려대학교), 라마 땅감 (Ramar Thangam) (공동저자, 고려대학교), 최효준 (공동저자, 고려대학교), 나 리 (Na Li) (공동저자, 고려대학교), 신정은 (공동저자, 고려대학교), 전유상 (공동저자, 고려대학교), 박현수 (공동저자, 고려대학교), 김유진 (공동저자, 고려대학교), 우데이 쿠마 스쿠마르 (Uday Kumar Sukumar) (공동저자, Stanford University), 송재준 (공동저자, 고려대학교), 박승근 (공동저자, 공주대학교), 유승호 (공동저자, 고려대학교), 강윤찬 (공동저자, 고려대학교), 이기범 (공동저자, Rutgers University), 퀴앙 웨이 (Qiang Wei) (공동저자, Sichuan University), 김동휘 (공동저자, 고려대학교), 한승민 (공동저자, 한국과학기술원), 라마사미 폴무루간 (Ramasamy Paulmurugan) (공동저자, Stanford University)
[ 연구의 주요내용 ]
1. 연구의 필요성
- 줄기세포는 주변의 환경을 감지하여 분화 자극이 가해지면 그에 상응하는 뼈, 지방, 근육, 심근, 혈관, 연골 등 다양한 기관 조직 세포로 분화할 수 있다. 최근에는 이러한 특성을 이용하여 재생의학 및 공학 분야에서 손상된 장기, 조직을 재생시키기 위해 줄기세포가 많이 연구되고 있다. 줄기세포의 재생능력을 효과적으로 제어하기 위한 방법으로 생체 내에서의 리간드 제시를 이용한 기술들이 널리 이용되고 있으며, 기존의 마이크로 규모 인테그린 리간드 펩티드(RGD)가 숙주 줄기세포의 부착은 조절하지만 줄기세포의 분화를 조정하는데 한계가 있다.
- 콜라겐과 같은 세포 접착성 세포외 기질 단백질의 가역적인 신장 및 수축 작용은 세포 골격 액틴과 초점 접착 복합체의 조직을 효과적으로 자극할 수 있다고 알려졌으나, 이를 나노소재로 구현하는 연구는 보고되지 않았다.
- 따라서, 세포외 기질을 효과적으로 모사하고 세포 접착성 RGD 리간드의 간격을 실시간 원격으로 가역적으로 제어할 수 있는 나노코일 시스템은 줄기세포의 부착과 분화, 그리고 세포역학신호변환 (mechanotransduction) 메커니즘에 대한 이해에 큰 기여를 할 수 있을 것으로 예상된다.
2. 연구내용
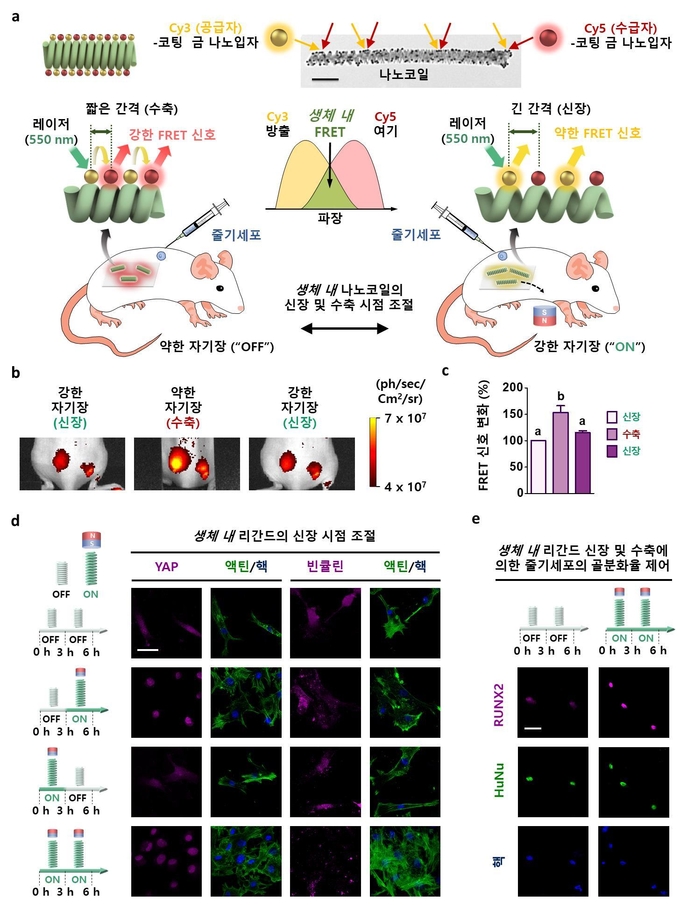
- 전기도금 방법을 이용하여 코발트-철 합금 나노코일을 제조하였고, 나노코일 표면에 세포 부착성 RGD 리간드를 코팅하여 생체 내/외에서 자기장으로 리간드의 간격을 원격, 실시간으로 조절할 수 있는 나노코일 시스템을 개발하였다.
- 구체적으로, 나노코일은 약 70 nm 두께의 나노선들이 외경 180 nm, 총 길이 1 μm로 꼬인 나선형 구조를 갖고, 나노코일 시스템은 외부 자기장에 의해 최대 26% 신장할 수 있으며, 자기장이 없을 때는 원래 상태로 수축하여, 세포에 제시되는 세포 접착성 RGD 리간드의 간격을 실시간 원격, 가역적으로 제어할 수 있다.
- 또한, 나노코일은 세포 내부로 함입되거나 부러지지 않는 기계적 강도를 갖고 있으며, 생체 내에서도 가역적으로 신축할 수 있는 특성을 갖는다.
- 체외 및 체내 세포 실험에서 동일하게 외부 자기장을 인가하여 나노코일의 간격이 늘어난 상태 즉, 세포 접착성 RGD 리간드의 간격이 늘어난 신장 상태에서 줄기세포의 부착 및 골분화율이 확연히 증가하는 것을 확인할 수 있었다.
- 이러한 실험 결과를 기반으로 체외 및 체내 세포 실험에서 줄기세포의 부착과 골분화의 차이를 확인함으로써 나노코일의 RGD 제시 간격을 원하는 시점에 원격으로 조절하여 줄기세포의 세포 부착 및 분화 촉진의 정밀한 제어가 가능함을 검증할 수 있었다.
3. 연구성과/기대효과
- RGD 리간드가 코팅된 나노코일의 구조를 원격으로 제어하여 세포에 제시되는 리간드의 폭을 제어하였고, 이를 기반으로 줄기세포의 부착 및 분화 능력을 효과적으로 조절할 수 있었다.
- 본 연구에서 개발된 나노코일은 줄기세포의 부착과 분화를 조절하여 원하는 장기나 조직의 재생 등 다양한 재생의학에 사용될 수 있을 것으로 기대된다.
- 본 연구를 통해 나노코일의 구조 제어 효과가 입증되었기 때문에 향후 연구들에서 세포 부착 조절을 위해 구조 제어가 가능한 다른 새로운 구조체들의 개발 등으로의 연구 확장이 가능할 것으로 예측된다.
-고안된 나노코일 시스템은 줄기세포 뿐 아니라 대식세포, 암세포 등에도 적용이 가능할 것으로 예상되며 나노소재들을 활용한 바이오 메디컬 분야에 폭넓은 연구 가능성을 제시할 것으로 기대된다.
- 본 나노코일 구조는 자기장을 이용하여 치료 시점의 원격 제어가 가능하기 때문에 최근 중요한 이슈로 떠오르고 있는 맞춤형 의료에 맞추어 환자 치료에 상용화될 가능성이 있다.
그림 설명

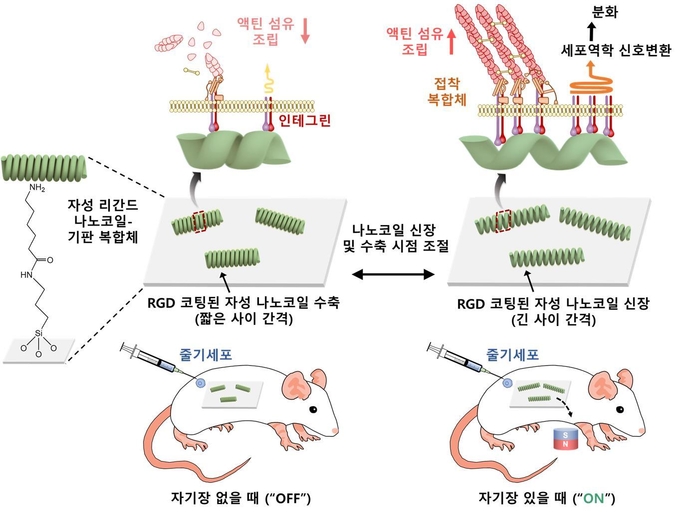
(그림1) 생체내 나노코일 제어 시스템의 모식도
나노코일을 이용하여 임플란트 소재 표면 위에서 리간드의 간격을 자기장으로 정밀하게 제어할 수 있는 나노크기의 신장/수축을 통한 줄기세포의 부착 및 분화의 조절이 가능한 시스템의 모식도.
(그림2) 생체내 리간드 간격에 따른 줄기세포 제어 시스템의 모식도
나노코일은 외부 자기장을 이용하여 실시간 원격으로 리간드의 간격을 조절할 수 있도록 유도되었고, 자기장에 의해 나노코일이 신장하여 리간드가 넓은 간격으로 제시될 때 줄기세포의 부착율과 골세포로의 분화율이 성공적으로 향상되는 모식도
연구 이야기
<작성자 : 고려대학교 김영근, 강희민 교수>
□ 연구를 시작한 계기나 배경은?
기존에는 환자 맞춤형 재생 치료 등 생체에 적용되어 매우 큰 이슈를 가지고 있는 줄기세포의 분화를 조절하기 매우 어려웠는데, 나선형 구조를 갖는 자성 나노코일을 이용하면 줄기세포의 접착 및 분화 반응을 실시간 원격으로 제어할 수 있을 것이라 생각했습니다.
□ 연구 전개 과정에 대한 소개
자기적 특성을 갖고, 가역적으로 신축할 수 있도록 소재의 종류, 크기, 및 형태를 조절하고자 하였습니다. 또한, 가장 중요한 연구 이슈로 삼았던 것이 구상한 나노소재가 생체 내/외에서 얼마나 늘어나고 줄어드는지를 확인하는 것이었습니다. 이러한 부분을 검증하기 위하여 합성한 나노코일을 크기와 구조를 투과전자현미경(TEM, Transmission Electron Microscope) 이용하여 정밀하게 조절하였고 진동시편자력계(VSM, Vibrating Sample magnetometer)을 이용하여 가역적인 자기적 특성을 갖는지 확인하였습니다. 그 이후, 원자간력현미경(AFM, Atomic Force Microscope)로 생체 외에서 나노코일이 얼마나 늘어나는지 확인하였고, 실제 생체 내에서 펠스터 공명 에너지 전이(FRET, Förster Resonance Energy Transfer) 현상으로 코일이 가역적으로 신장, 수축하는 과정을 검증하였습니다. 또한, 세포 접착 이후에도 구조적 안정성이 유지되는지 기계적 강도를 주사전자현미경-집속이온빔(SEM-FIB, Scanning Electron Microscope - Focused Ion Beam)에서 인장강도를 측정하여 검증하였습니다. 그 이후 나노코일의 표면에 세포 접착 RGD 리간드가 기능화되는 과정을 푸리에변환 적외분광 분석법(FT-IR, Fourier Transform Infrared Spectrometry)으로 확인하였고, 완성한 나노코일을 기판 위에 매우 균일하게 분산시켰습니다. 기판에 부착된 나노코일들이 실제로 줄기세포의 부착과 분화에 큰 영향을 주는지 보기 위해 체외 세포 실험을 통해 각 부착 및 분화에 상응하는 단백질들을 염색하여 공초점 레이저 현미경 (CLSM, Confocal Laser Scanning Microscope)으로 검증한 후 마우스를 이용한 생체실험으로 체내에서도 이러한 시스템이 작동할 수 있다는 것을 확인하였습니다.
□ 연구하면서 어려웠던 점이나 장애요소는 무엇인지? 어떻게 극복(해결)하였는지?
나노코일은 총 길이가 1 μm인 매우 짧은 나노소재로, 수 ~ 수십 nm 크기의 간격으로 주기성이 반복되는 구조를 갖고 있습니다. 이러한 나노코일이 실제 응용과정에서 자기장 신호로 실시간, 가역적이고 신속한 신장/수축이 가능한지를 검증하는 과정이 가장 까다로웠습니다. 이를 해결하기 위하여 나노코일의 구조를 명확히 이해하고, 다양한 분야의 전문가들과 토의 및 협업을 진행하며 나노코일의 실시간 신장/수축 과정을 AFM, FRET, CLSM을 이용하여 다각도로 검증하였습니다.
□ 이번 성과, 무엇이 다른가?
지금까지 많은 연구자들이 세포의 부착에 영향을 주는 RGD를 사용하고 있지만 이를 줄기세포에 제시한 이후 세포 반응을 켰다 껐다 반복할 수 있는 소재를 고안하는 연구는 많이 미진한 상황이었습니다. 그러나 본 연구진들이 개발한 자성 나노코일 시스템과 같이 외부 자극으로 실시간, 주기적으로 줄기세포의 접착과 분화가 조절되는 연구는 지금까지 보고된 바 없는 매우 독창적인 연구결과입니다.
□ 꼭 이루고 싶은 목표나 후속 연구계획은?
세포의 임상적용 가능성을 확인하고 향후 조직 재생 치료 분야를 새롭게 개척하여 환자 개개인의 상황에 따른 맞춤형 치료 시스템을 구축하는 것이 목표입니다. 또한, 줄기세포뿐만 아니라 현재의 나노코일을 이용한 실시간 나노-리간드 간격 조절은 대식세포, 암세포에도 적용 가능할 것으로 기대됩니다. 이번 나노코일 연구를 기반으로 ‘건강 100세 시대’를 여는데 한걸음 더 나아갔으면 하는 바램입니다.
연구자 소개

강희민 교수, 교신저자
1. 인적사항
· 소속 : 고려대학교 공과대학 신소재공학부
· 전화 : 02-3290-3270
2. 학력
· 2011-2016년 : University of California at San Diego 재료공학, 박사
· 2005-2008년 : Stanford University 재료공학, 석사
· 1998-2005년 : 고려대학교 신소재공학과, 학사
3. 경력사항
· 2019-현재 : 고려대학교 신소재공학부 조교수
· 2016-2019년 : The Chinese University of Hong Kong 박사후 연구원
· 2011-2016년 : University of California 연구원
· 2008-2010년 : Applied Materials, Inc. R&D Process Engineer
· 2005-2008년 : Stanford University 연구원
4. 전문분야 정보
· 원격제어형 (자성, 빛, 자가조립, 초음파 등) 나노공학 신소재 개발
· 시공간 제어형 개인 맞춤형 나노바이오메디컬 공학
5. 연구지원 정보
· 2020년 ~ 현재 : 과학기술정보통신부 이공분야기초연구지원사업 신진연구자지원사업

김영근 교수, 교신저자
1. 인적사항
· 소속 : 고려대학교 공과대학 신소재공학부
· 전화 : 02-3290-3281
2. 학력
· 1987-1993년 : MIT 재료공학과, 박사
· 1981-1987년 : 서울대학교 공과대학 금속공학과, 학사/석사
3. 경력사항
· 2021~현재 : 한국자기학회 회장
· 2018~현재 : 한국공학한림원 일반회원
· 2015~현재 : 한국과학기술한림원 정회원
· 2008~2011 : 고려대학교 산학협력단 단장
· 2000~현재 : 고려대학교 교수
· 1997~2000년 : 삼성전기주식회사 수석연구원
· 1993~1997년 : 미국 퀀텀코퍼레이션 엔지니어
4. 전문분야 정보
· 재료공학 (자성재료, 나노재료)
· 나노소재 융합기술 (바이오메디컬 응용)
5. 연구지원 정보
· 2019년 ~ 현재 : 과학기술정보통신부 이공분야기초연구지원사업 중견연구자지원사업

민선홍, 제1저자
1. 인적사항
· 소속 : 고려대학교 공과대학 신소재공학과
· 전화 : 02-3290-3853
2. 학력
· 2020-현재 : 고려대학교 대학원 신소재공학과 석박사통합과정
· 2013-2019년 : 고려대학교 공과대학 신소재공학부, 학사
3. 전문분야 정보
· 자성 원격제어형 나노공학 신소재 개발
· 자성 시공간 제어형 개인 맞춤형 나노바이오메디컬 공학

고민준, 제1저자
1. 인적사항
· 소속 : 고려대학교 공과대학 신소재공학과
· 전화 : 02-3290-3899
2. 학력
· 2016-현재 : 고려대학교 대학원 신소재공학과 석박사통합과정
· 2010-2016년 : 고려대학교 공과대학 신소재공학부, 학사
3. 전문분야정보
· 신소재공학 (금속/금속산화물 소재 합성, 나노재료, 자성재료)
· 나노융합소재 (바이오메디컬 응용)
