
(주)카나프 테라퓨틱스, 이병철
1. 2019년과 ADC(antibody-drug conjugate)
2019년은 항암제 바이오 신약 계열중에 하나인 항체 약물 중합체, ADC 분야가 항암분야의 미충족 수요를 해결할 수 있는 가능성을 보여주며, 바이오 신약으로써 가치를 재조명 받은 한 해 였다.
기존 ADC는 종양에 타겟팅 하는 항체에 강한 세포 독성을 가진 약물(free paylord cytotoxic IC50 < sub nM)을 결합시킨 중합체로, 면역관문억제제가 암에 대한 좋은 반응률로 각광을 받기전까지 새로운 암 치료제로서 많은 주목을 받았던 물질이었다. 시장에도 HER2 양성 유방암 치료제인 Kadcyla, 호지킨 림프종 치료제인 Adcetris, 그리고 급성 골수성 백혈병 치료제인 Mylotarg이 나와있어 많은 제약사들의 관심을 가졌던 물질이었다. 기존 케모테라피가 가지고 있는 단점이었던 강항 독성과 삶의 질의 저하 문제를 ADC가 해결해 줄 것 이라는 기대가 있었다.
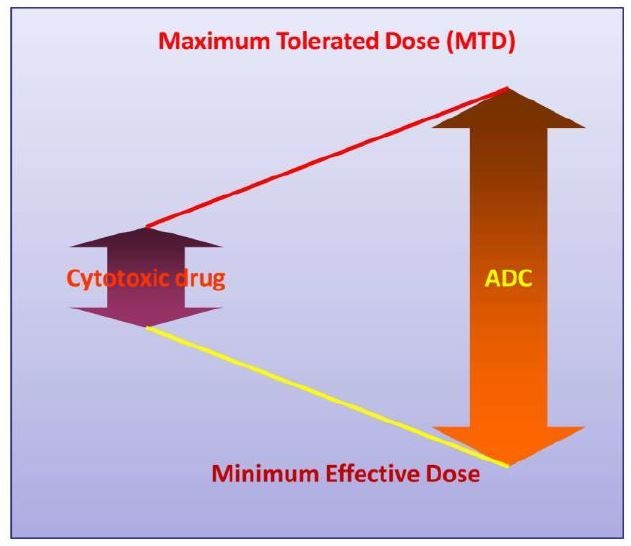
그림1. ADC가 케모테라피보다 넓어질거라 예상하고 있는 치료영역(therapeutic window, 독성용량과 효력용량의 차이)을 표시한 모식도
그 이유는 그림1에서 보는 것처럼 ADC는 기존의 케모테라피와 비교할 경우 치료영역이 넓어진 개선된 효과로 독성을 많이 완화시켜줄 것이라는 예상이 이었기 때문이다. 실제로 동물을 대상으로 하는 전임상 실험에서는 효력용량과 독성용량의 차이가 많이 벌어져 인간에서도 이런 효과를 기대하는 것은 당연했다. 하지만 실제로 임상에서의 결과를 보면 예상했던 것과 달리 치료 영역이 넓지가 않았다. Kadcyla의 경우를 보면 3주마다 1번씩 정맥주사를 하는 경우 효력용량이 3.6mg/kg으로 정해져 있는 반면, 독성용량은 혈소판 감소증이라는 투여량 제한 독성(dose-limiting toxicity)으로 인해 4.8mg/kg이상 올리지 못하게 되었다.(1,2)
Adcetris인 경우도 마찬가지로 3주마다 1번씩 정맥주사를 하는 경우 효력용량은 1.8 mg/kg으로 정해져 있는 반면, 독성용량은 호중구 감소증이라는 투여량 제한 독성 (dose-limiting toxicity)으로 인해 2.4 mg/kg이상 올리지 못하게 되어있다. (3)
ADC 분야를 선도하고 있었던 제넨텍의 경우 MMAE라고 하는 약물을 결합시킨 ADC 물질 8개가 임상 1상과 2상에 올라가 있었으나 2016년과 2017년에 걸쳐 CD79b를 타겟팅하는 ADC를 제외한 나머지 임상 프로그램들을 중단 시킨적이 있었다. 그 이유는 Adcetris와 마찬가지로 투여량 제한 독성으로 인해 종양 반응 비율이 높지 않아 시장성의 문제로 중단된 것이 아닌가 하는 예측을 해 볼 수 있다. (4)
하지만 새로운 기술의 등장과 면역 관문 억제제와의 병용요법의 가능성으로 인해 ADC는 새로운 국면을 맞이했고, 임상시험에서 뛰어난 효력을 보이는 ADC 물질이 나와 2개의 ADC 물질이 미국 FDA에서 허가를 받게 되었다. 이로 인해 현재 ADC에 대한 재조명이 이루어지고 있는 상황은 틀림없어 보인다.
2019년에 미국 FDA에 허가된 ADC는 EnhertuR 와 Polivy 두가지 약물이 있다. EnhertuR (fam-trastuzumab deruxtecan-nxki)의 경우는 일본 다이이찌산쿄에서 DS-8201이라는 코드네임으로 개발되었는데, HER2 양성 유방암에서 전이가 일어나거나 수술이 불가능한 유방암 환자를 대상으로 개발된 후, 아스트라제네카에 도입되었고, 2019년 12월 19일 미국 FDA에 승인되었다. 임상 2상의 결과는 ORR (Objective response rate) = 60.3%, median duration of response = 14.8 months, median PFS (Progression free survival) = 16.4 months로 기존의 약물에 비해 월등히 뛰어난 효능을 보여주었다. DS-8201은 anti-HER2 항체인 trastuzumab에 topoisomerase I 저해제 계열인 exatecan을 붙였으며, 임상 1상에서 Kadcyla가 보여주었던 투여량 제한 독성이나 심혈관계 관련 독성은 전혀 보여주지 않았다. 이로 인해 HER2 발현이 적은 환자에게도 투여가 가능하게 되었고, Kadcyla의 성능을 훨씬 능가하는 약효와 독성 프로파일을 보여주었다. 기존의 ADC에 결합하는 약물들이 DM1이나 MMA1과같은 미세소관 억제제가 대부분이었다면 DS-8201인 경우는 새로운 개념의 약물을 결합시킨 것이 눈에 띄는 부분이다. (5)
Polivy (polatuzumab vedotin-piiq)의 경우는 제넨텍에서 anti-CD79b 항체에 MMAE 약물을 결합시킨 ADC로 재발성/난치성 계열의 비만성 거대 B세포 림프종에 대한 적응증을 대상으로 개발되었으며 2019년 6월 10일에 미국 FDA에 accelerated approval로 승인되었다. (6)
글락소스미스클라인 (GSK)의 다발성 골수종을 적응증으로 하는 ADC인 Belantamab mafodotin (GSK2857916)는 anti-CD38 항체에 미세소관 억제제인 MMAF를 결합한 물질로 재발성/불응성 다발성 골수종 환자 대상으로 31%의 ORR을 보여주었으며, 조만간 DREAMM-2 trial의 결과를 바탕으로 FDA 승인 여부가 결정될 예정이다. (7)
Sacitizumab Govitecan은 미국의 Immunomedics라는 회사에서 개발한 ADC로 anti-Trop2 항체에 SN-38이라는 일본 다이치 산쿄에서 사용했던 약물과 같은 기전의 topoisomerase I 저해제를 결합시켜 IMMU-132라는 코드네임으로 개발되었고, 전이성 삼중음성 유방암 (triple negative breast cancer, TNBC)에 대한 적응증으로 현재 미국 FDA에 BLA중이며, 현재 진행중인 임상3상 ASCENT trial의 결과가 나오는 2020년 초에 허가에 대한 결정이 내려질 전망이다. (8)
또한 면역관문 억제제인 anti-PD1과의 병용요법도 눈에 띄는 부분이다. 시애틀 제넥틱스와 일본의 아스텔라스 파마에서 공동 개발하고 있는 국소 진행성 또는 전이성 요로 상피 암을 대상으로 개발한 enfortumab vedotin는 anti-Nectin4 항체에 MMAE를 결합한 ADC인데, 머크사의 anti-PD1 면역관문 억제제인 키투르다와 병용하는 요법으로 개발 중에 있다. 임상 1b/2 초기 결과를 보면 73.3%의 좋은 ORR을 보이고 있다. (9)
이처럼 2019년에 ADC 분야에서는 많은 성과들이 나왔으며, 기존의 ADC 물질이 치료영역의 차이가 좁아 이로 인해 생기는 독성의 문제로 종양 반응률이 낮았던 문제들을 새로운 개념의 약물을 결합시키거나 새로운 종양 타겟팅의 항체로 극복해 나가고 있으며, 또한 ADC 자체로 면역관문 억제제와의 병용요법에 대한 파트너로의 가능성을 보여준 한해였다.
2. 현재 ADC 개발 현황
2015년에 항암제 약물개발 파이프라인의 상당수를 ADC가 차지할 정도로 ADC 개발은 관심이 높았던 항암제 신약의 한 분야였다. 앞서 기술한 대로 투여량 제한 독성과 이로 인한 좁은 치료 영역, 그리고 기대가 높았던 DM1과 MMAE 약물을 기반으로 한 ADC의 고형암에서의 낮은 종양 반응률은, 면역항암제가 보여준 기대이상의 성과로 인해 ADC는 약물개발의 주된 관심에서 벗어나 있었다. 하지만 앞서 서술한 대로 2019년 기대 이상의 효능을 보여주고 있어 앞으로 항암제의 한 영역으로 다시 자리매김 할 것은 분명할 것으로 보인다.
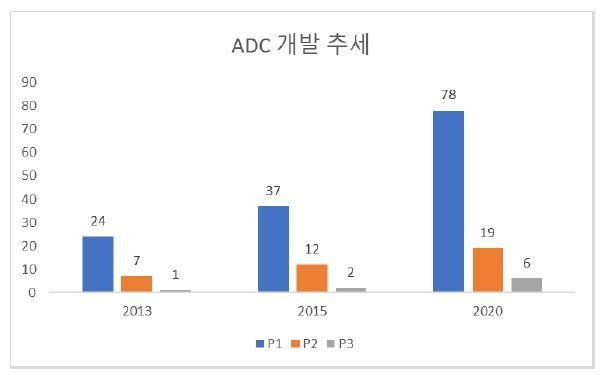
그림2. ADC 개발 추세. Integrity (Clarivate Analytics) 데이터 베이스를 사용하여 분석한 결과다.
현재까지 ADC 개발 추세를 보면 ADC pipeline이 지속적인 성장을 하고 있는 것을 알 수 있다. 그림2에서 보는 것처럼 2013년에 임상에 32개의 ADC 물질이 있었던 반면 2020년 2월 기준으로 103개의 물질이 임상에서 테스트되고 있다. 한가지 흥미로운 사실은 임상에서 임상1상이 차지하는 비율은 2013년, 2015년 그리고 2020년을 비교해 볼 때 70% 정도로 그렇게 차이가 나지 않는다는 것이다.
이러한 지표는 일반적인 항암제 개발 시 각 단계별 성공확률을 고려할 경우 생기는 임상 1상, 2상 그리고 3상의 분포와 유사함을 알 수 있고, 이러한 지표가 나타내는 것은 ADC가 다른 항암제 분야와 마찬가지로 활발하게 연구가 되고 있음을 알려주고 있다. 2019년에 보여주었던 ADC의 좋은 성과가 앞으로 개발 추세에 어떤 영향을 미칠지 기대가 된다.
3. ADC 치료제가 되기 위한 조건들
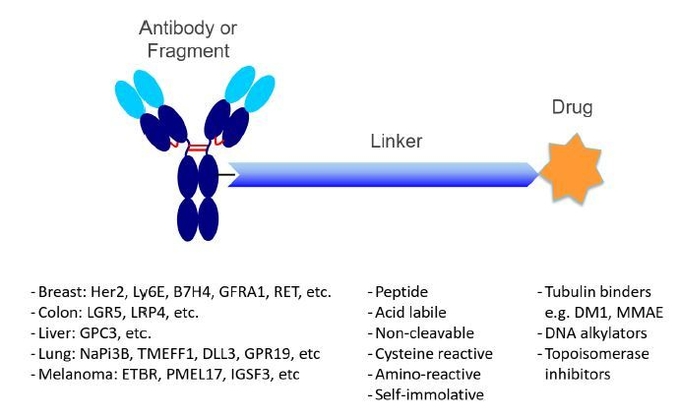
그림3. ADC 모식도. 대략적인 ADC 종양 타겟과 사용되고 있는 링커와 약물들
그림3은 현재 개발되고 있는 ADC의 전반적인 구조와 함께 각 암종별로 대략적인 종양 타겟, 사용되고 있는 링커와 약물들을 보여주고 있다. 지금까지의 연구를 바탕으로 ADC 치료제가 되기 위한 대략적인 조건들을 살펴보면 다음과 같다.
먼저 종양 선택적인 타겟팅이 되어야 되기 때문에 종양세포 표면에서 발현이 많이 되어 있는 타겟을 선별하게 되는데, 지금까지 테스트되고 있는 ADC 항체들의 경우를 보면 대략적으로 종양세포에서 항체 타겟의 발현이 정상세표보다 10배 이상 되는 것을 볼 수 있다. 잘 알려진 HER2 타겟의 경우는 약 200만~300만개의 HER2 타겟이 종양세표에서 과다 발현되는 것을 볼 수 있다. (10)
ADC의 종양 타겟 선택적인 활성은 ADC 약물 개발의 가장 중요한 조건중의 하나라고 할 수 있다. 임상에 진입했던 ADC의 in vitro 세포주 실험결과를 보면 대부분의 경우 세포독성 potency IC50가 < low nM로 나타나고 있으며, non-targeting control과 비교했을 때 potency IC50의 차이가 적어도 100배 이상, 보통 1000배 정도 차이가 나고 있어 종양 타겟 선택적인 활성을 잘 보여주고 있다. 또한 타겟 발현 정도와 비례하게 세포독성 potency IC50값이 낮아지는 경향을 보여주는 실험도 진행하고 있는데, 타겟 선택적인 효능을 보여주는 좋은 실험이라고 할 수 있다.
이와 더불어 항체의 타겟 항원에 대한 바인딩 affinity, ADC가 세포내로 들어가는 경로, ADC에 붙인 약물의 potency와 작용기작, ADC의 비표적 효과 (off-target effect), 등이 ADC의 성공적 개발을 위한 고려 사항이 될 수 있다.
한가지 덧붙이고 싶은 중요 고려 사항은 항체가 종종 보이는 비선형 약물 동태학이다. 항체의약물 동태학에서는 TMDD (target-mediated drug disposition)이라는 현상이 주로 발생하는데, 종양세포에서의 타겟 발현으로 인해 생체내 주사 시 일정 농도 이하에서는 약물 동태학의 clearance가 빠르게 일어나고 일정 농도 이상이어야만 선형 약물 동태학을 보이는 경우이다. 예를 들면 HER2 양성 유방암인 경우, 생체내에서 2 mg/kg 이상의 농도를 유지해야 선형 약물 동태학을 보이며 그 이하의 농도에서는 빠르게 clearance가 일어나는 TMDD 현상을 보이고 있다. 따라서 이 경우에는 anti-HER2 항체의 농도를 2 mg/kg 이상으로 주사를 해야 예측 가능하고 안정적인 종양 반응률을 가져올 수 있다. 다시 말하면 2 mg/kg 이상이 되어야 HER2 타겟을 항체로 포화시킬 수 있는 것이다. (11, 12) 이로 인해 anti-HER2 ADC를 개발하는 경우에 너무 강한 약물을 결합하는 경우, 유방암 환자에서 2 mg/kg 이상의 양으로 주사를 할 수 없는 경우에는 종양 반응률을 예측하기 힘든 상황이라 볼 수 있다. 혈액암인 경우에는, 예를 들면 CD30, CD33, CD22, CD79b, CLL1 등등을 타겟하는 ADC인 경우는 0.5 mg/kg 정도에서 해당 타겟을 포화시킬 수 있다고 알려져 있고, 이 경우에는 강한 세포독성을 가지는 약물을 항체에 붙일 수 있다 (13). 예를 들면 강한 세포 독성을 가지는 PBD (pyrrolobenzodiazepines) 계열의 약물들이 혈액암 ADC 물질에 많이 쓰이는 이유이기도 하다. 하지만 PBD 계열의 약물이 고형암으로 아직 성공적이지 못한 이유는 타겟 포화를 시키기 위해서는 선형 약물 동태학에 해당되는 양으로 주사를 해야 되는데 이럴 경우 생기는 독성으로 쉽게 개발하지 못하는 문제가 아닐까 추측된다.
그림3에서 보는 것처럼 ADC를 구성하는 요소에는 항체, 링커 그리고 약물의 3가지 요소가 있다. 이 세가지 요소가 서로 잘 맞아야 치료영역을 넓힐 수 있는 치료제로 개발이 되는데, 이 세가지 요소 중에 치료영역의 효력용량과 독성용량을 결정하는 가장 중요한 요소는 무엇일까? 이 질문에 대한 논의를 ADC 연구자들끼리 종종 하는데 아직까지 확실한 답은 없는 듯하지만 몇 가지 방향성은 짚어볼 수 있다. 첫번째는 항체의 종양 선택성인데 지금까지 연구된 ADC 항체의 정맥주사나 피하주사후 시간별 생체 내 분포 (biodistribution)를 보면 하루가 지난 뒤에 ADC 물질이 종양에 많이 축적되는 양상을 보이지만 긴 반감기로 인해 시간이 갈수록 혈액, 간, 심장, 폐, 신장, 비장, 위, 등등 곳곳의 장기로 분포가 되는 것을 볼 수 있으며 (14), 이러한 자연적인 분포를 피할 수 있는 방법은 아직 없는 듯하다. ADC의 독성 양상을 보면 이를 증명하듯 간, 신장 또는 골수에서 독성이 종종 나타난다. 두번째는 링커의 역할인데 ADC 링커로써 기본적으로 기대하고 있는 효과는 체내에서 순환되거나 분포가 될 때 안정성을 유지하고 종양내로 침투해서 세포내로 들어가는 경우에만 선택적으로 잘려나가 항체에 결합돼 있는 약물을 release하는 것이다. 링커의 안정성에 따른 효능과 독성을 본 실험들의 결과를 보면 링커의 안정성을 줄여 혈액내에서 일정속도로 release가 되는 경우, 효능의 감소로 효력용량이 늘어나는 반면 해리된 약물의 빠른 clearance로 독성이 감소돼 독성용량도 늘어나게 되는 것을 볼 수 있으며, 링커의 안정성을 증가시키면 이에 따라 효능의 증가로 효력용량이 줄어드는 반면 독성도 증가돼 독성용량도 줄어드는 것을 볼 수 있다 (15). 이는 링커의 안정성이 효력용량의 변화를 가져 올 수는 있으나 이에 따라 독성용량도 차이를 주기 때문에 치료영역이 넓어지는 효과가 아닌 치료영역의 변화만 생기는 경우가 될 것이다. 세번째는 ADC에 붙이는 약물의 효과인데 지금까지 보여준 임상에서의 결과들을 보면, 이뮤노젠(ImmunoGen)에서 개발한 mcc-DM1, 시애틀 제네틱스에서 개발한 mc-VC-PAB-MMAE 링커 약물들이 어떤 암종의 타겟 항체를 쓰더라도 mcc-DM1을 썼던 ADC인 경우는 대략적으로 3.8 mg/kg 정도의 효력용량을 보였고, mc-VC-PAB-MMAE를 썼던 ADC의 경우는 1.8 mg/kg 정도의 효력 용량을 보였다. (4) 또한 같은 항체를 쓰더라도 서로 다른 약물을 사용할 경우, Kadcyla와 EnhertuR의 경우를 비교해 보면 효력용량의 차이와 더불어 치료영역이 넓어지는 개선의 효과가 생겼다. 이를 바탕으로 치료영역의 범위를 결정하는 요인은 ADC에 붙인 약물에 기인한 것이 아닌가 추측해 볼 수 있다. 앞으로 많은 ADC들의 임상 결과들이 나올 예정이므로 이를 토대로 좀더 정확한 답을 얻을 수 있지 않을까 생각된다.
4. 2020년대 차세대 ADC의 방향
앞서 기술한 대로 항체에 결합하는 약물이 치료영역을 결정짓는 중요한 역할을 하고 어떠한 약물을 결합하느냐에 따라 치료영역이 넓어질 수 있다는 가능성으로 많은 ADC 바이오텍 회사들이 항체에 붙이는 약물을 다양화시키는 노력을 진행하고있다. 지금까지는 Free payload의 세포독성 IC50 값이 < sub nM 정도 되는 물질들이 ADC 약물로 주로 선택이 되어 사용가능한 ADC 약물들이 많지는 않았으나, 세포독성 IC50 값이 적어도 단 단위 nM 정도되는 약물들을 ADC 약물로 쓸 수 있는 가능성이 제기 되고 있고, 이와 더불어 적지 않은 제약사에서 new-linker drug 프로그램을 운용하여, 세포독성 IC50 값이 적어도 단 단위 nM 정도되는 약물들을 포함한 다양한 약물들을 ADC형태로 테스트하고 있다.
또한 ADC에 결합하는 약물도 지금까지는 종양세포를 사멸시키는 세포독성 약물 개발에 초점이 맞추어져 있다면, 최근에는 약물의 작용기전을 다양화 시키는 노력이 진행되고 있고 전임상 단계에서 효능을 보여주는 사례가 생기고 있어 이들을 주목해 볼 필요가 있다.
이와 관련해서 첫번째 예를 들면 ADC를 통해 면역시스템을 조절하는 물질들이 전임상에서 테스트되고 있다. 실버백 (Silverback Therapeutics) 이라는 바이오텍에서는 Anti-HER2 항체인 trastuzumab에 면역조절물질인 TLR8 길항제를 결합시킨 SBT6050를 단일치료제로 개발하고 있으며 최근 샌안토니오 유방암 심포지엄에서 발표된 결과를 보면 단일치료제로 HER2 타겟이 중간이나 고농도로 발현된 동물 종양 모델에서 효능을 보였고, 기존의 면역 항암제가 보여주지 못한 골수 유래 면역 세포들의 활성으로 인한 기전임을 보여주었다. (16) 이와는 반대 기전으로 ADC가 면역억제제로 활용된 예가 있는데, 스크립스의 피터 슐츠 교수 연구팀에 의해 개발된 ADC는 anti-CXCR4 항체에 tyrosine kinase inhibitor인 다사티닙 (dasatinib)을 붙인 경우로 T-cell receptor (TCR)-mediated T cell activation을 막아 면역 억제제로의 적용 가능성을 보여 준적이 있다. (17)
두번째 예는 세포내 특정 단백질을 분해하는 목적으로 PROTAC 계열의 약물을 항체에 결합하여 테스트한 사례가 최근에 보고되었다. (18) 이 경우는 급성 백혈병 림프종 (acute myeloid lymphoma, AML)에 발현돼 있는 CLL1이라는 타겟에 바인딩하는 anti-CLL1 항체를 이용하였는데, 세포 핵 내에 존재하며 종양발생의 중요한 역할을 하는 에피제넥틱스 단백질중의 하나인 BRD4를 선택적으로 타켓팅해 분해시키는 BET degrader를 항체에 결합시켰다 (그림 4 참조).
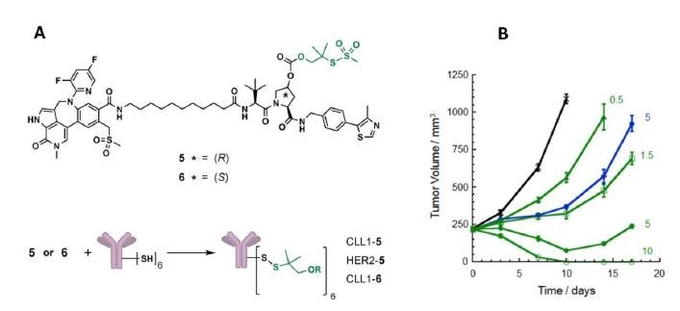
그림4. 제넨텍에서 개발한 Anti-CLL1 BET degrader conjugate. A는 BET degrader의 구조와 이황화 결합을 이용한 conjugate의 구조. B는 AML의 동물 모델인 HL-60 xenograft에서 보여주고 있는 CLL1-5의 효력. 정맥 주사된 ADC의 양은 mg/kg 단위로 각 그래프 옆에 표시되어 있다. (18) 각 그림은 논문에서 발췌했다.
그림4에서 보는 것처럼 HL-60 마우스 xenograft 모델에서 5 mg/kg 투여시 종양 발생이 억제가 되는 것을 볼 수 있다. 보통 PROTAC 계열의 degrader들은 약물 동태학과 치료제로써 약물 프로파일이 좋지가 않아 개발상의 여러 문제가 있다. 하지만 위의 예처럼 종양 타겟팅 항체에 결합시킴으로 이런 문제점을 개선시킬 뿐 아니라, 종양 선택성으로 독성 완화에 대한 효과도 볼 수 있을 것으로 기대할 수 있다. 더불어 이 연구의 특징으로 세포내 단백질을 ADC로도 조절이 가능하다는 점을 뽑을 수 있다.
위에서 든 사례처럼 2020년대 ADC의 방향은 항체나 링커보다는 당분간 항체에 결합시키는 약물 개발 및 약물의 기전에 초점이 맞춰지지 않을까 예상해본다.
참고문헌
(1) J. Clin. Oncol. 2010, 28(1):2698-2704
(2) J. Clin. Oncol. 2011, 29(4):398-405
(3) Invest. New Drugs 2019, 37(4):738-747
(4) Mab 2019, 12(1):e1699768
refractory-multiple-myeloma/?keywords=Belantamab+Mafodotin
(8) https://www.biospace.com/article/immunomedics-prepping-for-launch/?keywords=Sacitizumab+Govitecan
combination-with-pembrolizumab-in-first-line-advanced-bladder-cancer/?keywords=seattle+genetics+Astellas
(10) Nucleic Acids Res. 2015, 43(2):1189-1203
(11) Cancer 2012, 118(23):5733-5740
(12) Cancer Chemo. Pharma. 2012, 69(5):1229-1240
(13) Clin Cancer Res. 2019, 25(4):1358-1368
(14) Oncotarget, 2019, 10(58):6234-6244
(15) Personal communication
development-of-sbt6050-as-a-single-agent-and-in-combination-with-trastuzumab-for-the-treatment-of-her2-expressing-malignancies/?keywords=Silverback
(17) J. Am. Chem. Soc. 2015, 137(9):3229-3232
(18) Chem. Med. Chem. 2020, 15:17-25
