
OAK 3상 임상 결과 티쎈트릭® 전체생존기간 13.8개월로
도세탁셀 대비 4.2개월 개선 확인1
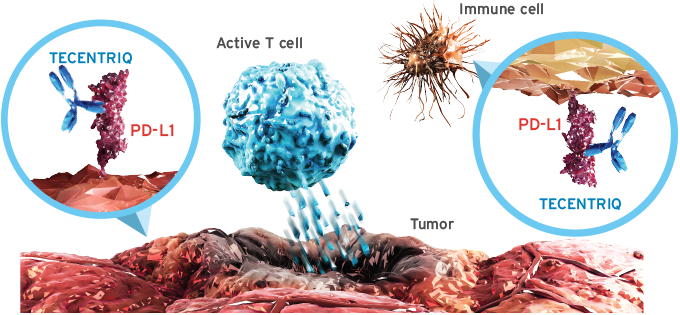
㈜한국로슈(대표이사: 매트 사우스, Matt Sause)는 OAK 3상 임상 연구를 통해 임상적 유효성 및 안전성을 확인한 자사의 항 PD-L1 면역항암제 티쎈트릭®(Tecentriq®, 성분명:아테졸리주맙)이 5월 비소세포폐암 적응증에 대해 식품의약품안전처의 허가를 받았다고 밝혔다1,2.
티쎈트릭®의 적응증은 백금 기반 화학요법제 치료 중 또는 치료 이후에 질병이 진행된 국소 진행성 또는 전이성 비소세포폐암으로, EGFR 또는 ALK 변이가 확인된 환자는 투여하기 전에 이러한 변이에 대한 승인된 치료제를 투여한 후에도 질병의 진행이 확인된 경우여야 한다2. 티쎈트릭®은 OAK 3상 임상 연구에서 PD-L1 발현율과 관계 없이 전체생존기간(OS, Overall Survivor)을 연장한 것으로 나타났다1.
티쎈트릭®의 OAK 3상 임상 결과, 티쎈트릭® 투여군의 전체생존기간 중앙값은 13.8개월로 대조군(도세탁셀, 9.6개월) 대비 4.2개월 개선됐다(HR=0.73, 95% CI: 0.62-0.87, p=0.0003)1. 주요 유효성 평가 변수(Co primary endpoint) 였던 임상에 등록된 환자 전원(ITT, intention-to-treat)에서뿐만 아니라 TC 1/2/3 또는 IC 1/2/3 (종양세포 또는 종양침윤세포상 1% 이상의 PD-L1 발현) 환자군에서도 전체생존기간의 개선을 보고했다1.
아울러, 하위 분석 결과에 따르면 PD-L1 발현율이 적거나 감지되지 않는 환자군에서도 전체생존기간 개선을 보였다1. 티쎈트릭®은 도세탁셀 대비 우호적인 안전성 프로파일을 나타냈으며, 치료 관련 3,4등급 이상반응 발생률이 낮았다1. 티쎈트릭®은 기존에 보고된 이상반응과 일관됐으며, 대조군 대비 폐렴을 포함하는 면역 매개 이상반응 발생률은 낮았다1.
㈜한국로슈 의학부 김수정 상무는 “티쎈트릭®은 암세포와 면역세포에 존재하는 PD-L1 단백질과 결합해 T-세포의 항암 효과를 회복시키는 기전으로 폐암 치료에서 임상적 유효성 및 안전성을 확인한 면역항암제[3]”라며 “OAK 3상 임상 연구를 통해 티쎈트릭®이 비소세포폐암 환자에게 새로운 치료 옵션이 될 수 있음을 확인했다1”고 밝혔다.
OAK 3상 임상 연구는 백금 기반 화학요법제로 치료 받은 경험이 있는 국소 진행성 및 전이성 비소세포폐암에서 티쎈트릭®의 임상적 유효성 및 안전성을 확인하기 위해 31개국 194개 기관에서 진행됐다1. 티쎈트릭®은 연구에 참여한 1225명의 환자 중 무작위 선택된 850명에 대한 일차 분석 결과를 바탕으로 허가를 받았다1,2.

㈜한국로슈 매트 사우스 대표이사는 “다양한 암에서 선도적인 표적치료제를 선보이며 종양학 분야의 역사를 다시 써 온 로슈는 매년 10조 원 이상을 R&D에 투자하며 환자들에게 더욱 혁신적인 치료 옵션을 제공하기 위해 노력해 왔다[4]”며, “최초의 항 PD-L1 면역항암제 티쎈트릭®을 통해 국내 전이성 폐암 환자들에게 새로운 희망을 줄 수 있도록 최선의 노력을 다할 것”이라고 밝혔다.
티쎈트릭®은 백금 기반 화학요법제 치료 중 또는 치료 이후에 질병이 진행된 국소 진행성 또는 전이성 비소세포폐암 환자에게 1200mg을 3주 간격으로 정맥 점적주입하며, 질환이 진행되거나 허용 불가능한 독성 발생 전까지 투여한다2.
References
[1] Achim Rittmeyer, et al. Lancet. 2017 Jan 21;389(10066):255-265 (OAK Study)
[2] 식품의약품안전처>의약품/화장품 전자민원창구>정보마당>의약품등정보>제품정보>티쎈트릭 (https://ezdrug.mfds.go.kr/)
[3] FDA News Release, May 18, 2016 (http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm501762.htm)
[4] Roche Annual Report 2016
