항당뇨․항비만 효과 나타내 당뇨병 치료 기대
울산과학기술원 최장현 교수팀, 세계적 권위의 학술지 다이아비티즈(Diabetes) 게재
PPARg antagonist Gleevec improves insulin sensitivity and promotes the browning of white adipose tissue
백혈병 치료제로 쓰이고 있는 ‘글리벡’이 당뇨 발병의 주요 인자를 억제해 혈당을 낮추면서도 부작용은 없어 비만 및 당뇨 치료의 새로운 가능성을 제시한 연구 결과가 발표되었다.
* 글리벡 (Gleevec) : 스위스의 노바티스(Novartis)사가 개발한 만성 골수성 백혈병(CML) 치료제. 만성 골수성 백혈병의 주원인인 필라델피아 유전자(BCR 유전자와 Abl 유전자의 염색체 전위로 인해 만들어지는 암유전자)에 의해 만들어지는 티로신 카이네이즈의 활성을 선택적으로 억제하여 항암효과를 가짐. 기존 항암제와 다르게 큰 부작용이 보고되지 않음. 위암과 관련된 위장관 기저 종양(GIST)에도 약효가 있다고 알려져 있음.
한국연구재단(이사장 정민근)은 미래창조과학부 바이오·의료기술개발사업의 지원을 받은 최장현 교수 연구팀(울산과학기술원)이 항암제 글리벡이 피피에이알감마(PPARγ)**를 조절하여 고혈당과 비만을 완화시켜 인슐린에 대한 저항성을 개선시킨다는 점을 최초로 규명했다고 밝혔다.
** 피피에이알감마(PPARγ) : 지방세포의 생성 및 분화에 필수적인 단백질임. PPARγ는 리간드가 결합하여 활성을 가지는 전사인자로서 지방 대사, 당 대사 및 염증 반응을 조절하는 핵심 인자로 기능을 한다.
당뇨병 치료제로 널리 사용되고 있는 기존 티아졸리딘다이온계(thiazolidinediones) 약물***은 혈당 조절에는 탁월하지만 저혈당, 신부전증, 심혈관계 질환 등 심각한 부작용을 초래해 이를 대체할 수 있는 새로운 당뇨병 치료제 개발이 시급한 상황이다.
*** 티아졸리딘다이온계(thiazolidinediones) 약물 : 피피에이알감마를 표적 단백질로 하는 항 당뇨 치료제로써 피피에이알감마의 전사활성을 증가시켜 피피에이알감마의 타겟 유전자들의 발현을 증가시켜 근육과 지방 조직에서 인슐린의 작용을 향상시키고, 혈당을 낮추는 탁월한 효과를 가진다. 로지글리타존과 피오글리타존이 이 약물류에 속한다.
최장현 교수 연구팀은 최근 연구를 통해 당과 지질 대사 항상성에 관여하는 유전자를 조절하는 피피에이알감마(PPARγ)에 인산(P)이 붙는 인산화가 당뇨 발병에 밀접한 연관이 있다는 것을 확인했고, 피피에이알감마(PPARγ)에서 인산(P)을 떼어내는 것만으로도 항 당뇨 효과가 있다는 것을 밝혀냈다.
연구팀은 피피에이알감마(PPARγ)에 인산(P)이 결합함을 측정할 수 있는 새로운 화합물 스크리닝 (chemical screening) 기법을 개발하였고 백혈병 치료제로 쓰이고 있는 '글리벡'이 피피에이알감마(PPARγ)에 특이적으로 결합하여 인산화를 억제한다는 것을 밝혀냈다.
기존 연구에서 글리벡을 투여한 암환자에서 혈당이 낮아지고 인슐린 저항성이 개선됨을 관찰하였지만 정확한 분자 기전은 불분명한 상태였다.
연구팀은 비만생쥐에 글리벡을 투여해 피피에이알감마(PPARγ)의 인산화를 억제한 결과, 인슐린 저항성이 개선되었고, 피하지방조직의 백색 지방세포****가 갈색지방세포*****로 변하면서 에너지를 소비해 체중 감소효과를 보인 것을 통해 글리벡이 항당뇨 효과 뿐 아니라 항비만 효과도 가짐을 밝혔다.
**** 백색지방세포 : 보통 우리가 “지방”이라고 일컫는 하얀 지방세포로 에너지를 저장하는 역할을 함. 피하나 장기 주위 등에 고루 퍼져 있음.
***** 갈색지방세포 : 갓 태어난 아기나 동면하는 동물은 백색 지방세포보다 갈색지방세포를 더 많이 볼 수 있음. 목 근처, 신장, 부신, 복부에 발달되어 있으며 나이가 들수록 세포가 감소한다. 열을 생산해 에너지를 소비하는 기능을 함.
최장현 교수는 이번 연구는 “피피에이알감마(PPARγ) 인산화 억제라는 새로운 개념과 함께 새로운 당뇨병 치료제로서 '글리벡'의 가능성을 확인한 것으로 항당뇨 치료제 신약 개발의 초석이 될 것”이라고 연구의 의의를 설명했다.
당뇨병 분야 국제 학술지 다이아비티즈(Diabetes)에 1월 5일 게재되었다.
> 논문의 주요내용
□ 논문명, 저자정보
- 논문명 : PPARg antagonist Gleevec improves insulin sensitivity and promotes the browning of white adipose tissue (피피에이알감마의 길항제인 글리벡이 인슐린 감수성을 증가시키고, 백색 지방의 갈색지방화를 촉진한다.)
- 저자 정보 : 최선실 박사 (제1저자, 울산과학기술원), 김은선(울산과학기술원), 정지은(울산과학기술원), 마르시아노 데이빗(Scripps Florida), 조아라(서울대학교), 구자영(서울대학교), 최수연(울산과학기술원), 양용렬(울산과학기술원), 장현준(울산과학기술원), 김응균(울산과학기술원), 박지영(울산과학기술원), 권혁무(울산과학기술원), 이인희(현대약품), 박승범(서울대학교), 명경재(울산과학기술원), 서판길(울산과학기술원), 패트릭 그리핀(Scripps Florida), 최장현 교수 (교신저자, 울산과학기술원)
□ 논문의 주요 내용
1. 연구의 필요성
○ 전 세계적으로 경제성장, 노인인구 증가와 서구화된 생활양식의 변화로 당뇨병의 유병률이 폭발적으로 증가하고 있으며, 이를 극복하기 위한 연구가 주목받고 있다.
○ 현재 당뇨병 치료제로 널리 사용되고 있는 치료제들은 혈당 조절에 탁월한 효능을 보이고 있지만 저혈당, 신부전 및 심혈관계 질환 등의 부작용을 초래하는 것으로 알려져 새로운 당뇨병 치료제 개발이 절실히 필요하다.
2. 발견 원리
○ 리간드에 의해 활성화 되는 전사인자인 피피에이알감마(PPARγ)의 인산화는 당뇨 발병의 주요 인자임에 착안하여 인산화를 억제하는 화합물이 당뇨병 치료 효과를 가질 것이라고 가정하였다.
○ 기존의 안전성을 인정받은 약물들에 대한 새로운 효능을 밝혀 새로운 용도로 신약을 창출하는 방법인 drug repositioning 개념을 도입하여 피피에이알감마(PPARγ)의 인산화를 억제하는 화합물을 찾은 결과, 글리벡이 피피에이알감마(PPARγ)에 특이적으로 결합하여 활성을 유도하지 않으면서 인산화만 억제하는 것을 발견하였다
3. 연구 성과
○ 피피에이알감마(PPARγ)의 활성없이 인산화만을 특이적으로 억제하는 화합물이 기존의 부작용을 최소화하면서 항당뇨 및 항당뇨 효과를 나타내는 것을 확인함으로써 비만과 당뇨를 동시에 치료 및 개선시킬 수 있는 치료제 개발의 새로운 방향을 제시하였다.
> 연구결과 개요
1. 연구배경
ㅇ 전 세계적으로 만성 질환, 특히 비만, 당뇨 등의 대사성 질환에 대한 연구가 큰 주목을 받고 있는 가운데, 대사성 질환의 주된 형태로 나타나는 제 2형 당뇨병을 극복하기 위한 신약 개발 연구에 많은 관심과 투자가 이루어지고 있다.
ㅇ피피에이알감마 (peroxisome proliferator-activated receptor γ, PPARγ)는 리간드에 의해 활성화되는 핵 내 호르몬 수용체 상과 (superfamily)에 속하는 전사인자로서 지방세포 분화 및 지질, 염증, 당의 항상성에 관여하는 유전자를 조절하는 것으로 알려져 있다. 현재 당뇨병 치료제로 널리 사용되고 있는 thiazolidinediones(TZDs) 계열의 화합물은 PPARγ의 리간드로서, PPARγ에 선택적으로 작용하여 인슐린 감수성을 향상시킨다. 하지만 이러한 TZDs계열의 약들은 PPARγ의 활성을 증가시켜 생체 인슐린 저항성을 완화시키지만, 여러 부작용을 일으키는 유전자의 발현도 함께 조절하여 우혈성 심부전, 부종, 비만, 골절 등의 부작용을 동반하는 것으로 나타나 그 사용이 점차 제한되고 있어 새로운 당뇨병 치료제의 개발이 필요하다.
ㅇ 최근 연구를 통해 PPARγ의 Ser273 잔기의 인산화가 당뇨의 발병과 밀접한 연관이 있으며, 인산화를 억제하는 물질들이 PPARγ의 활성과는 무관하게 항당뇨 효과를 보이며, 이러한 물질들은 TZD 계열의 약들이 나타내는 심각한 부작용들을 동반하지 않는 것을 확인하였다. 이러한 연구 결과는 당뇨 발병 및 치료제 개발의 새로운 target으로써 “PPARγ의 Ser273잔기 인산화 조절”이라는 새로운 방향을 제시하였다.
ㅇ 신약개발 프로그램은 오랜 개발 기간, 임상에서의 높은 실패율과 고비용으로 인해 어려움을 겪고 있다. “Drug repositioning”은 기존의 약물들을 새로운 용도로 신약을 창출하는 방법으로 전 세계적으로 주목을 받고 있는 신약개발의 패러다임이다. 이는 초고속 약물 검색을 통해 신규 용도의 검색을 단기간에 수행함으로써 기존 약물의 효용 가치를 극대화할 수 있게 된다.
ㅇ따라서 본 연구에서는 “drug repositioning”이라는 새로운 패러다임을 도입하여 FDA-approved drug library를 기반으로 PPARγ의 인산화 억제 물질 탐색하고 새로운 당뇨병 치료제 개발의 가능성을 확인하였다.
2. 연구내용
ㅇ 글리벡은 PPARγ에 특이적으로 결합하여 PPARγ를 활성화시키지 않으면서 in vitro, cell-based system 모두에서 PPARγ 의 인산화를 선택적으로 억제하였다.
ㅇ 글리벡의 in vivo에서의 항당뇨 효과를 확인하기 위해 10주간 고지방식이를 먹인 실험용 쥐에 Gleevec을 1주간 투여한 후 당 부하 검사와 인슐린 부하 검사를 실시하였다. 그 결과, 글리벡투여군은 대조군에 비해 유의적으로 혈당이 감소하였고, 인슐린 저항성이 개선되었다. 또한 TZD계열의 항 당뇨 치료제의 부작용으로 알려진 부종, 뼈골절, 체중증가, 심부전증 등에 대한 위험성이 관찰되지 않았다.
ㅇ Gleevec은 고지방식이를 먹인 마우스의 간조직과 간세포에서 지질 합성 및 당생성을 조절하는 유전자의 발현을 억제함을 확인함으로써 글리벡이 인산화를 억제하여 지질 및 당대사를 조절하였음을 알 수 있었다.
ㅇ 또한 지방조직에서는 인슐린 저항성을 유발하는 염증성 인자의 유전자 발현을 효과적으로 억제하였으며, 세포수준에서의 결과를 통해 지방조직에서 관찰된 글리벡의 항염증 효과는 지방세포와 대식세포에서 염증 반응을 효과적으로 억제하여 대식세포가 지방조직으로 침윤하는 것을 억제함으로써 나타난 결과임을 확인하였다.
ㅇ 한편 글리벡은 백색지방의 갈색지방화 (browning)과 갈색지방의 활성화를 촉진하였다. 고지방식이를 먹인 마우스에 글리벡을 3주간 투여 한 결과, 대조군에 비해 글리벡 투여군에서 유의적인 체중 감소 효과와 함께 에너지 소비량이 유의적으로 증가하는 것이 관찰되었고, Cold exposure시 글리벡 투여군에서 체온이 유의적으로 높게 유지되었으며, 피하지방과 갈색지방 조직에서 지방산화 및 발열 등에 관련된 유전자의 발현이 모두 유의적으로 증가하는 것을 관찰하였다. 따라서 글리벡은 백색지방의 갈색 지방화 및 활성화를 유도하는 것을 알 수 있었다.
ㅇ 결론적으로 이번 연구에서 글리벡은 PPARγ의 리간드로 작용하여 인산화를 억제함으로써 간에서 당생성을 억제하고, 지방간을 개선하며, 지방조직에서 만성적 염증 반응을 억제하고 갈색지방화를 통한 에너지 소비를 증가시킴으로써 인슐린 감수성을 증가시키는 것으로 사료된다.
ㅇ 따라서 본 연구는 제 2형 당뇨병의 핵심 원인이 PPARγ의 인산화에 있음을 증명하고, 인산화를 특이적으로 억제하는 글리벡의 항당뇨․항비만 효능을 비만생쥐 모델에서 확인함으로써 새로운 항당뇨 및 항비만 치료제 개발에 원천 기술을 제시하였다.
3. 기대효과
ㅇ 본 연구에서는 PPARγ의 인산화에 의한 간에서의 포도당 생성 증가, 지방조직에서의 만성적 염증반응 유도가 당뇨병 유발의 핵심 원인임을 새롭게 규명하였고, 항암제로 알려진 글리벡이 이러한 인산화를 선택적으로 억제하여 항당뇨 효과를 나타내는 것을 확인하였다. 이러한 분자 기작과 drug reposition 개념을 도입한 새로운 접근 방법은 향후 기존의 당뇨병 치료제의 부작용을 최소화하는 새로운 당뇨병 치료제 개발에 핵심기술이 될 것으로 기대한다.
> 연구이야기
□ 연구를 시작한 계기나 배경은?
핵수용체 PPARγ를 타켓으로 하는 thiazolidinediones(TZDs)계열의 당뇨병 칠제가 개발되어 미국 FDA의 승인을 받아 치료에 사용되었지만 뛰어난 인슐린 저항성 개선 효과에도 불구하고 심혈관계질환을 유발하는 등 심각한 부작용이 보고되어 시장에서 퇴출되었음. 따라서 TZD계열의 강력한 혈당강하 작용을 유지하면서 부작용을 최소한 할 수 있는 새로운 치료제의 개발이 필요하였고 이를 위한 새로운 화합물을 발굴하고자 이 실험을 계획하였음.
□ 연구 전개 과정에 대한 소개
Gleevec을 screening 과정에서 발견한 후 많은 시도를 거쳐 항비만, 항당뇨 효과를 관찰하였고 이를 위해 많은 연구자들의 도움에 의해 이번 연구가 이루어 질 수 있었음.
□ 연구하면서 어려웠던 점이나 장애요소가 있었다면 무엇인지? 어떻게 극복(해결)하였는지?
Gleevec 투여한 생쥐에서 항당뇨, 항비만 효과를 관찰하고 그 분자 기전을 밝히는 과정이 매우 힘들었음. 이를 위해 많은 논문 및 동료 연구자의 자문들을 바탕으로 연구를 수행하였음.
□ 이번 성과, 무엇이 다른가?
기존 PPARγ를 target으로 하는 치료제와는 달리 부작용을 최소화 할 수 있는 새로운 분자 기전을 증명한 것
□ 꼭 이루고 싶은 목표와, 향후 연구계획은?
글리벡은 기존에 부작용이 적은 항암제로 사용되었기 때문에 임상에서 약물의 효능만 입증되면 약물의 안전성에 대한 검증 단계 없이 바로 임상 적용이 가능하다. 하지만 “항암제”라는 선입견 때문에 당뇨 환자들에게 적용하기에는 환자들로부터 거부감을 일으킬 수 있다. 따라서, 글리벡을 선도물질로하는 유도체를 합성하여 새로운 형태의 항당뇨 치료제를 개발해보고 싶다.
> 용어설명
1. Diabetes 誌
○ 당뇨병 분야 국제 학술지로 내분비학 및 대사 (Endocrinology & Metabolism)분야에서 5% 이내 (피인용지수 : 8.474)
2. 글리벡 (gleevec)
○ 스위스의 노바티스(Novartis)사가 개발한 만성 골수성 백혈병(CML) 치료제.
○ 만성 골수성 백혈병의 주원인인 필라델피아 유전자(Bcr 유전자와 Abl 유전자의 염색체 전위로 인해 만들어지는 암유전자)에 의해 만들어지는 티로신 카이네이즈의 활성을 선택적으로 억제하여 항암 효과를 나타낸다.
○ 기존 항암제와 다르게 큰 부작용이 보고되지 않으며, 위암과 관련된 위장관 기저 종양(GIST)에도 약효가 있다고 알려져 있다.
3. 핵 수용체 (nuclear receptor)
○ 세포의 유전자 발현 변화를 통해 세포의 발생이나 성장, 분화를 조절하는 하는 호르몬의 수용체.
○ 리간드와 결합하여 활성화되어 유전자 발현을 조절하는 전사인자이다.
> 그림설명
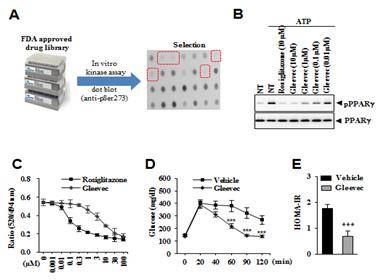
그림 1. 글리벡은 피피에이알 감마의 인산화를 억제하여 인슐린 저항성을 개선한다.
- 그림 A : FDA에서 승인받은 화합물 라이브러리에 대해서 in vitro kinase assay를 실시하여 피피에이알 감마의 인산화를 억제하는 화합물을 스크리닝하였다.
- 그림 B : 글리벡은 농도 의존적으로 피피에이알 감마의 인산화를 억제하였다.
- 그림 C : 글리벡이 피피에이알 감마의 리간드인지를 확인하기 위해 리간드 결합능력을 측정하였다. 그 결과 농도 의존적으로 리간드에 결합하는 것을 알수 있었다.
- 그림 D, E : 글리벡의 항당뇨 효능을 확인하기 위해 정상 쥐에 고지방식 (high fat-diet)를 10주간 실시한 뒤 글리벡을 7일간 매일 투여하였다. D, 포도당 저항성 검사 결과 글리벡을 투여한 쥐는 비교 생쥐와는 달리 고농도 포도당에 대한 체내 저항성이 의미있게 개선되었다. E, HOMA-IR, 인슐린 저항성을 나타내는 인덱스인 HOMA-IR도 글리벡 투여 쥐가 개선되었음을 알 수 있었다.
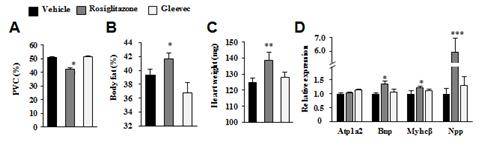
그림 2. 글리벡은 thiazolidinediones(TZDs)계열의 화합물이 나타내는 부작용이 나타나지 않는다.
Tiazolidinediones(TZDs)계열이 나타내는 부작용에 대한 글리벡의 영향을 확인하기 위해 정상 쥐에 고지방식을 10주간 실시한 뒤 글리벡을 14일간 투여하였다.
- 그림 A : 헤마토크릿(hematocrit), 헤마토크릿은 혈액에서 적혈구가 차지하고 있는 용적의 비중을 백분율로 표시한 것으로 혈액에 수분함량이 높으면 적혈구 용적 백분율(packed cell volume, PVC)이 감소하게 된다. 이는 부종을 판단할 수 있는 지표가 되는데, 기존의 TZD계열의 화합물인 로지글리타존 (rosiglitazone)은 비교생쥐에 비해 PVC가 유의적으로 감소한 반면, 글리벡을 투여한 생쥐에서는 변화가 관찰되지 않았다. 따라서 글리벡의 투여로인한 부종은 나타나지 않는 것으로 사료된다.
- 그림 B : Body fat 함량, 체중증가에 대한 글리벡의 영향을 확인한 결과, 로지글리타존을 투여한 생쥐는 비교 생쥐에 비해 유의적으로 지방함량이 증가하였으나, 글리벡은 아무런 변화가 관찰되지 않았다. 따라서 글리벡 투여에 의한 체중 증가는 나타나지 않는 것으로 사료된다.
- 그림 C, D : 심부전증 발병에 대한 글리벡의 영향 평가, 글리벡의 심부전증 발병에 대한 영향을 평가하기 위해 심장 무게와 심부전 마커 유전자의 발현을 살펴본 결과, 비교 생쥐에 비해 로지글리타존 투여 생쥐는 심장 무게와 함께 마커 유전자의 발현이 증가하였으나 글리벡은 이러한 효과가 나타나지 않았다.
따라서 글리벡은 TZDs계열의 약물이 나타내는 부작용을 일으키지 않는 것으로 사료된다.
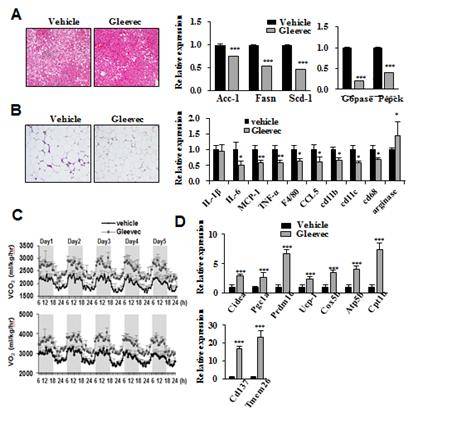
그림 3. 글리벡은 지방간을 개선하고 지방조직의 리모델링을 유도한다.
- 그림 A : 지방간 변화, 비교 생쥐에 비해 글리벡 투여 생쥐의 간에서 지질축적이 현저히 저하된 것이 관찰되었고 지질합성에 관련된 유전자(ACC-1, FASN, SCD-1)와 당생성에 관련된 유전자 (G6Pase, PEPCK)의 발현이 현저히 감소한 것이 관찰되었다.
- 그림 B : 지방조직의 염증관련 인자 변화, 비교 생쥐에 비해 글리벡 투여 생쥐의 지방에서 대식세포의 침윤 현상이 현저히 감소된 것이 관찰되었고, 대식세포 마커 유전자 (F4/80, CCL5, CD11b)와 만성 염증성 인자(IL-1b, IL-6, MCP-1)는 유의적으로 감소한것에 반해 항염증성 인자 (Arg)는 유의적으로 증가한 것이 관찰되었다.
- 그림 C : 에너지 소비 측정, 글리벡의 에너지 소비에 대한 영향을 살펴보기 위해 대사케이지(metabolic cage)를 이용하여 산소 소비량과 이산화탄소 발생량을 측정하였다. 그 결과, 글리벡을 투여한 생쥐가 비교생쥐에 비해 산소 소비량과 이산화탄소 소비량이 유의적으로 증가하여 글리벡에 의해 생쥐의 에너지 소비량이 증가한 것임을 알 수 있었다.
- 그림 D : 피하지방 조직에서의 유전자 유전자 발현 조사, 글리벡을 투여한 생쥐의 피하 백색지방 조직에서 열생성 관련 유전자 (PGC-1α, UCP-1), 갈색지방 관련 유전자 (CIDEA, PRDM16, ATP5b, COX5b), 지방 산화관련 유전자(CPT-1b), 베이지 지방세포 마커 유전자(CD137, TMEM26)의 발현이 유의적으로 증가하였음이 관찰되었다. 이 결과는 피하 백색 지방이 갈색지방화 되었음을 나타내는 것으로 글리벡이 백색 지방을 갈색 지방화(browning)를 유도하여 에너지 소비를 증가시켰음을 알 수 있다.
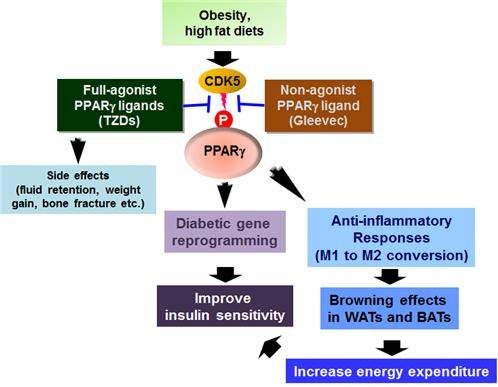
그림 4. 글리벡에 의한 항비만, 항당뇨 효과 기전 모식도.
- 비만에 의하여 지방세포내의 CDK5가 활성화되면 PPARg의 Ser273잔기가 특이적으로 인산화된다. 이 인산화에 의해 인슐린 저항성이 기인하는 것으로 많은 보고에서 밝혀졌다. 본 연구는 Gleevec에 의해 인산화가 특이적으로 억제되고 당뇨 발병 유전자의 reprogramming을 통해 인슐린 저항성이 개선된다. 또한, 인산화 억제에 의해 염증 반응이 억제되도 염증 억제 반응을 통해 백색지방의 갈색지방화가 촉진되면서 에너지 대사 및 소비가 늘어나게 되고 이를 통해 항비만 효과가 나타나게 된다. 종합적으로 Gleevec에 의해 부작용이 거의 없는 새로운 항비만, 항당뇨 효과가 나타난다.