암세포 사멸을 유도, 항암제의 부작용이 낮은 약물전달 플랫폼 개발 기대
Mitochondrial Induced and Self-Monitored Intrinsic Apoptosis by Antitumor Theranostic Prodrug: In Vivo Imaging and Precise Cancer Treatment.
국내연구진이 항암제가 정상세포가 아닌 암세포만 공격하도록 유도하는 저분자화합물을 발굴해냈다. 향후 기존 항암제를 보완하여 항암효과 개선과 부작용 극복에 기여할 것으로 기대된다.

고려대 화학과 김종승 교수 연구팀이 미래창조과학부가 추진하는 리더연구자지원사업(창의)의 지원으로 수행한 이번 연구의 결과는 화학분야 국제학술지 미국화학회지(Journal of the American Chemical Society) 11월 17일자 온라인판에 게재되는 한편 12월 24일 프린트판 표지논문으로 게재될 예정이다.
(논문제목 : Mitochondrial Induced and Self-Monitored Intrinsic Apoptosis by Antitumor Theranostic Prodrug: In Vivo Imaging and Precise Cancer Treatment. 암세포 미토콘드리아 매개 세포사멸 유도 및 실시간 모니터링 세라그노스틱 프로드러그: 동물 모델 이미지와 정밀한 암세포 표적 치료 효과)
뛰어난 효능에도 불구하고 항암제가 암세포 이외 정상세포에까지 영향을 미치는 경우 탈모나 구토, 어지러움, 급격한 체중감소 같은 부작용을 겪을 수 있다.
때문에 암세포만을 표적으로 사멸시킴으로써 항암효과를 향상시키는 한편 정상세포의 손상을 줄여 부작용을 줄일 수 있는 방법에 대한 연구가 활발하게 진행되고 있다.
연구팀은 암세포 특이적인 고농도의 세포내 과산화수소에 반응해 결합하고 있던 항암제(5-FU*)를 방출, 암세포만을 공격하는 물질을 발굴했다.
* 5-FU(5-플루오로우라실, 5-Fluorouracil) : 널리 사용되는 항암제로 세포내 DNA 합성을 저해하거나 RNA 기능 장애를 유발하여 암세포를 사멸 시킨다.
** 세라그노스틱7 : 세라피(therapy, 치료)와 다이그노스(diagnose, 진단)의 합성어인 세라그노스틱의 의미처럼 질병의 치료와 진단을 동시에 하는 화합물로 이번 연구에서 특히 암세포 표적 활성을 극대화시켜 발굴된 물질
정상세포에 비해 과산화수소 농도가 10배 가량 높은 암세포의 특성을 이용해 과산화수소가 많이 만들어지는 암세포의 미토콘드리아*를 공격하여 세포사멸을 유도하는 원리로 항암제의 부작용을 낮추기 위한 약물전달 플랫폼으로 응용될 것으로 기대된다.
* 미토콘드리아 : 에너지 대사 및 활성산소 항상성 유지 세포소기관
실제 표적항암제(세라노스틱7)를 인간의 암세포를 피하에 주사해 암을 유도한 생쥐모델에 투여한 결과 암 조직이 눈에 띄게 사멸되는 것으로 나타났다.
특히 표적항암제(세라노스틱7)는 이중나선 구조의 DNA를 이루는 두 사슬 가운데로 끼어들 수 있는 화합물(EtBr)을 포함, 암세포 사멸과정에서 나타나는 DNA 손상을 형광으로 모니터링 할 수 있다는 설명이다.
김종승 교수는 “기존의 낮은 항암효과를 나타내는 약물을 다분자로 결합시켜 항암효과를 극대화시킴과 동시에 암세포의 미토콘드리아를 선택적으로 공격하여 사멸시키는 과정을 실시간으로 모니터링 할 수 있는 항암제 합성기술을 개발한 것”이라고 밝혔다.
연 구 결 과 개 요
1. 연구배경
우리나라에서 각종 사망률 중 급격히 증가하고 있는 사인은 암으로 고령화 에 따라서 암 발생률도 같이 증가하고 있다. 암은 발병하는 각 조직의 특이성을 고려하여 진단과 치료를 하게 되지만 급성이거나 전이가 일어나면 발병 했던 조직의 한계를 넘어 전신으로 암세포가 급속도로 퍼져 생명을 위협하게 된다.
비록 암이 치료가 되었어도 재발의 위험이 있어 일반적으로 5년의 경과를 지켜 본 후, 완치판정을 받게 되는 질병이다. 따라서 실시간으로 암세포만을 특이적으로 진단 및 사멸 치료를 할 수 있는 물질인 세라노스틱(theranostic compound: therapy 치료 + diagnose 진단의 합성어) 개발이 절실한 상태이다. 지금까지 다양한 항암제들이 개발 되었지만 암세포들의 약물저항성(drug resistance)으로 인한 항암효과 저하 및 낮은 암세포 표적 사멸 기작으로 인한 부작용 문제들은 여전히 암을 정복하는데 장애요인 이었다.
2. 연구내용
본 논문에서 연구진이 합성한 세라노스틱 물질은 1950년도에 개발된 5-플루오로우라실(5-fluorouracil,5-FU)이라는 항암제를 포함하고 있는데 5-플루오로우라실 단독으로는 암세포의 약물저항성 때문에 대장암의 경우, 약 10~15%의 낮은 치료효과를 갖고 있어, 임상에서 5-플루오로우라실은 이리노테칸(Irinotecan)과 옥살리프랜틴(Oxaliplantin)과 함께 투여함으로써 함암효과를 약 40~50%로 상승시킬 수 있도록 사용하고 있다.
본 연구진은 항암제의 낮은 암세포 표적 사멸을 개선하기 위해서 암세포가 특이적으로 함유하는 고농도의 활성산소(ROS, reactive oxygen species)인 과산화수소(H2O2)를 이용하였다. 일반적으로 정상세포와 비교하였을 때, 암세포는 H2O2를 약 5uM~1.0mM의 농도로 체내에서 발생시키며, 이들 활성산소는 대부분 세포 내 에너지 생산과 활성산소의 항상성을 유지하는 미토콘드리아에 존재한다고 알려져 있다.
이러한 암세포 내의 H2O2에 의해 표적항암제(세라노스틱7)에 붕소 에스터 연결(boronic esters linkage)로 결합되어 있는 두 분자의 5-FU 항암제가 방출 되게 합성함으로써 약물효과를 높였고, 정상 세포에 대한 손상을 줄이고 암세포만을 공격하여 암세포 특이적인 고농도의 미토콘드리아 활성산소에 의해서 세포사멸을 유도하게 고안 하였다. 또한 세라노스틱 약제로써 DNA에 구조적으로 결합하여 DNA 손상을 추가적으로 유도함과 동시에 형광 ethidium bromide 분자를 가지고 있어 실시간으로 암세포 사멸을 측정할 수 있는 물질로 합성하였다. 예상대로 in vivo mouse xenograft model에서 밝혀진 메커니즘 연구에서 표적항암제(세라노스틱7)는 기존의 항암제 5-FU의 항암기작과는 다른 경로인 미토콘드리아 매개 세포사멸을 효과적으로 이끌어 내는 것으로 밝혀졌다.
3. 기대효과
본 연구는 기존의 낮은 항암효과를 나타내는 항암제를 다분자로 결합시켜 항암효과를 극대화시킴과 동시에 약물저항성을 극복할 수 있다는 새로운 패러다임을 제시하였고, 동시에 암세포의 미토콘드리아만을 특이적으로 공격하여 암세포사멸을 보다 정밀하게 유도하고, 세포사멸을 실시간으로 형광으로 진단할 수 있는 새로운 세라노스틱 항암제를 합성한데 본 연구의 의의가 있으며, 기존 임상에서 사용되는 항암제 중에 약물저항성으로 인해 항암효과가 저하된 약물들의 항암효과 증대와 항암치료 부작용 최소화에 기여할 것으로 기대됨.
연 구 결 과 문 답
이번 성과 뭐가 다른가
합성한 세라노스틱 물질은 낮은 항암효과를 나타내는 기존의 항암제를 다분자로 결합시켜 항암효과를 극대화함과 동시에 암세포의 미토콘드리아만을 특이적으로 공격하여 세포사멸을 유도하고, 실시간 세포사멸을 형광으로 진단할 수 있는 화학적으로 합성이 어려운 저분자화합물을 합성한 것이다.
어디에 쓸 수 있나
기존 임상에서 사용되는 항암제 중에 약물저항성으로 인해 항암효과가 저하된 약물들의 항암효과 증대와 항암치료 부작용 최소화에 기여할 것으로 사료된다.
실용화까지 필요한 시간은
본 연구진이 새롭게 합성한 세라노스틱7 물질은 표적항암제로 전임상 단계의 실험을 거쳐 향후 5-6년 내에 실용화 될 것으로 사료된다.
실용화를 위한 과제는
전임상단계, 임상 단계를 모두 연구할 예정
연구를 시작한 계기는
실시간 진단과 치료를 동시에 할 수 있는 세라노스틱 화합물에 대한 임상적 연구가치가 크다는 점을 고려하여 본 연구진은 저분자유기 화합물로 기존 항암제의 약물저항성으로 인한 항암 효과저하 개선과 암세포의 미토콘드리아 활성산소를 표적으로 특이적 세포사멸을 실시간으로 유도 및 진단하는 연구에 중점을 두고 연구를 진행하였다.
에피소드가 있다면
형광기의 고장으로 이곳저곳 다니면서 기기를 빌려 쓰느라 밤새 고생한 이야기
꼭 이루고 싶은 목표는
개발하고 있는 다양한 질병에 대한 세라그노스틱 화합물질들이 전임상 연구들을 통해서 진단과 질병 치료효과를 인정받고 더 나아가 임상에서 환자들의 생명과 많은 질환을 앓고 있는 사람들의 삶의 질을 향상시킬 수 있기를 바란다.
신진연구자를 위한 한마디
기존에 알려진 지식을 바탕으로 새로운 가설을 세우고, 최신 증명방법들을 통해서 가설을 증명하는 것에는 상당한 인내와 도전정신이 필요하다. 더욱이 요즘 같이 다양한 분야의 학문들이 “융합창조”의 개념에서 통합되어 연구 분석되는 시점에서는 다양한 학문에 대한 이해도가 절실히 요구된다. 따라서 신진연구자들의 개방된 연구자 마인드가 중요하며 서로가 협력하여 공동의 목표를 향해 나아가는 추진력을 갖춘 연구자가 되는 것이 중요하다.
용 어 설 명
1. Journal of the American Chemical Society
. 미국화학회가 발행하는 화학분야 국제학술지
2. 암세포의 약물저항성(drug resistance)
. 초기 암치료 과정 중 많은 항암제의 약물효과가 현저히 저하되는 현상이 발생하는데 이는 암세포가 약물에 노출되면 암세포 내로 약물이 흡수되었다가 항암효과가 나타나기 전에 다시 세포 밖으로 효율적으로 배출하여 세포의 사멸을 막기 때문이다.
3. 세라노스틱
. 세라피(therapy, 치료)와 다이그노스(diagnose, 진단)의 합성어로 질병의 치료와 진단을 동시에 하는 화합물
4. 미토콘드리아(mitochondria)의 ROS(Reactive oxygen species, 활성산소)
. 세포 소기관 중 에너지 합성공장인 미토콘드리아에서 에너지 대사 과정 중에 만들어지는 화학반응이 활발한 산소 분자를 함유한 물질들로 이들은 세포의 산화를 유도하여 세포의 노화, 사멸 및 암세포로의 변이를 유도하는 것으로 알려져 있다.
. 일반적으로 생리학적으로 활발한 대사를 하는 암세포의 미토콘드리아나 세포질 내에는 이러한 활성산소의 농도가 정상세포보다 높은 것으로 알려져 있다. 본 연구진이 합성한 세라노스틱 물질은 암세포 내의 고농도 활성산소와 결합하여 항암제인 5-FU 두 분자를 방출하는 저분자화합물질이다.
5. 누드 마우스 지노그래프트(nude mouse xenograft, 생쥐 이종이식 암모델)
. 본 논문에서 합성한 세라노스틱 물질(7)의 항암효과 및 기작 연구와 실시간 암세포 사멸을 형광으로 관찰하기 위해 인간의 암세포를 피하주사로 접종하여 암조직을 인위적으로 유발한 누드 생쥐 모델
6. EtBr(ethidium bromide)
. DNA나 RNA는 특정영역을 증폭하여도 워낙 작아서 육안으로 확인이 어렵기 때문에 에티디움 브로마이드로 염색하여 관찰. UV 등을 비추면 빛을 발하는 형광성화합물로 DNA의 이중 나선구조에 끼어들어 DNA의 존재와 위치를 시각적으로 확인할 수 있게 해줌
그 림 설 명
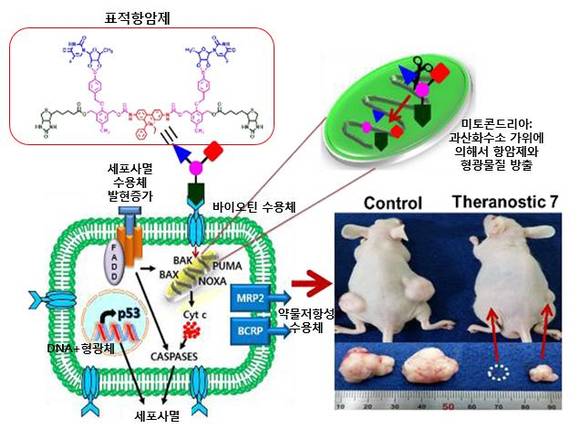
그림 1. 두 분자의 항암제와 형광 모니터링 분자인 이티디움(ethidium)을 달고 있는 표적항암제가 암세포의 바이오틴(biotin) 수용체와 결합하여 세포내로 흡수되고 흡수된 표적항암제는 미토콘드리아의 활성산소인 과산화수소 가위에 의해서 항암제와 형광체로 분리 방출된다. 표적항암제에 의해서 세포사멸 수용체 발현이 증가하고 미토콘드리아 매개 세포사멸 기작이 현저히 증가하였다. 동시에 떨어져 나온 형광체는 미토콘드리아 핵산 및 세포 핵 내의 핵산과 결합하여 진단에 용이한 형광을 띤다. 이 표적항암제를 사람의 암세포를 접종 시켜서 만든 암모델 마우스에 꼬리정맥주사로 주입하였더니 대조군에 비해서 효과적으로 암이 치유되었다.
그림 2. Journal of the American Chemical Society (JACS) December 24, 2014, Volume 136, Number 51의 표지논문으로 게재될 일러스트 그림. 세라노스틱 물질인 본 항암제는 가운데 형광체를 중심으로 두 개의 항암제와 두 개의 바이오틴 분자를 달고 있다.
(출처 ACS Publications)
