순수 국내연구진이 갑상선암의 발생에 DNA 메틸화*가 매우 중요한 역할을 하고 있다는 것을 새롭게 규명하였다. 향후 이를 활용한 악성 갑상선암의 진단 및 예후 마커의 실용화 기술 개발에 큰 기여할 것으로 기대된다.
가톨릭대학교 서울성모병원 병리과 정찬권 교수 연구팀과 한국생명공학연구원(이하 생명연) 유전자교정연구센터 김용성 박사 연구팀(교신저자: 김용성/정찬권 박사, 제1저자: 생명연 박종열 박사)이 공동으로 수행한 이번 연구는 보건복지부와 한국보건산업진흥원이 추진한 포스트게놈 다부처 유전체사업의 지원으로 수행되었고, 갑상선 분야의 세계적 저널인 싸이로이드(Thyroid, IF 7.786) 최근호(2020년, 30권 2호)에 게재되었다.
DNA 메틸화는 유전자 발현에 결정적인 영향을 미치는 후성학적 변화다. 인체의 각종 정상세포에서 종양억제유전자의 프로모터 DNA에는 메틸기가 부착되어 있지 않아 유전자 발현이 활성화되어 있으며, 반대로 종양유전자의 프로모터 DNA에는 메틸기가 부착되어 유전자 발현이 억제된 상태로 존재한다.
그러나, 정상세포에서 종양억제유전자의 프로모터 DNA가 메틸화되면 유전자 발현이 억제되고, 또한 종양유전자의 프로모터가 탈메틸화되면 유전자 발현이 활성화되어 암세포가 발생하게 된다. 그러므로 유전자 프로모터 DNA에서의 메틸화 변화가 암세포의 발생에 중요한 역할을 하게 된다.
최근 특정 세포 또는 질환 세포에서 프로모터와 멀리 떨어져서 유전자 발현의 조절에 참여하는 DNA 영역이 발견되었는데, 이를 인헨서(enhancer)라 부르며, 이 부위에서의 DNA 메틸화 변화가 인헨서의 기능을 조절하는 것으로 밝혀지고 있다.
갑상선암의 발생과 프로모터 DNA 메틸화의 관련성은 보고된 바 있으나, 인헨서 부위에서의 관련성은 아직 보고된 바 없으며, 특히 경계성 갑상선종양 및 악성 갑상선암을 식별할 수 있는 DNA 메틸화 분자 마커의 연구는 진행된 바 없었다.
연구팀은 인헨서 및 유전자상의 DNA 메틸화 변화가 유전자 발현에 영향을 주어 갑상선암 발생에 밀접한 관련이 있음을 최초로 밝히고, 특히 (MMP7, MICAL2, 및 DIAPH1 유전자상의) DNA 과메틸화가 악성 갑상선암에서 매우 낮은 빈도로 발생하는 사실을 발견했다.
이런 사실은 갑상선암 발생에 있어서 유전자상의 DNA 메틸화뿐만 아니라 인헨서의 DNA 메틸화 변화가 밀접한 관련이 있음을 규명한 것이라고 할 수 있다.
또한, 연구팀은 대규모 코호트 연구를 통해 해당 유전자 상의 DNA 메틸화 수치가 경계성 갑상선종양에 비해 악성 갑상선유두암종에서 급격하게 감소하는 것을 확인했으며, 예후가 나쁜 유형일수록 DNA 메틸화 수치가 더 낮게 나타난다는 사실을 확인했다.
공동 연구책임자인 정찬권 교수는 “갑상선에서 DNA 메틸화 연구는 그동안 연구가 미진한 분야였으나, 본 연구진은 최신의 기법을 활용해 신규 바이오마커를 발굴한 것은 매우 의미 있는 성과”라고 강조했다.
종 교수는 “DNA 메틸화 바이오마커를 활용한 검사법을 임상 현장에 도입한다면 갑상선 결절의 진단 정확성을 높여 불필요한 재검사나 수술을 줄일 수 있으며, 갑상선암으로 수술 받은 환자에게는 예후 판정 및 추후 치료 방침 결정에 도움을 주는 바이오마커로 활용할 수 있을 것으로 기대된다”고 밝혔다.
공동 연구책임자인 김용성 박사는 “동 연구 성과는 갑상선암의 발생 및 진행에 DNA 메틸화가 매우 밀접하게 관련되어 있다는 사실을 밝힌 것”이라며, “새로이 발굴된 (MMP7, MICAL2, 및 DIAPH1) 유전자 상의 DNA 과메틸 바이오마커를 활용해 악성 갑상선암의 진단 및 예후 판정을 위한 실용화 기술 개발에 큰 기여를 할 것으로 기대된다”고 밝혔다.
연구 결과 개요
□ 연구배경
· 갑상선유두암종(Papillary thyroid carcinoma, PTC)은 가장 흔한 갑상선암이며 과거 30년간 발병률이 크게 증가하였다. PTC는 이질적인 분자학적 및 임상적 특징들을 갖는 10개 이상의 조직학적 변형들이 존재한다.
· 2017년의 WHO(World Health Organization) 갑상선암의 분류기준에 따르면, 유두암종의 비침윤성피막형성소포형 (noninvasive encapsulated follicular variant)의 대부분은 여포갑상선종양(NIFTP, noninvasive follicular thyroid neoplasm with papillary-like nuclear features)으로 재분류되었다.
· 과거에 악성 유두암종의 한 유형으로 분류되었던 여포갑상선종양은 더 이상 악성이 아니며 불확실한 악성 잠재성을 갖는 경계성 종양(borderline tumor)으로 하향 분류됨으로 인해 이를 구분할 수 있는 바이오마커의 개발 필요성이 제기되어 왔다.
· DNA 메틸화(methylation)는 사이토신-구아닌 이중 뉴클레오타이드(CpG)에서 사이토신의 5‘ 위치에 메틸기가 첨가되는 가장 잘 알려진 후성학적 변화다.
· 종양세포에서 종양억제유전자(tumor suppressor gene)의 비활성화는 유전자의 프로모터 부위에서 과메틸화(hypermethylation)을 통해 발생할 수 있고, 종양 유전자(oncogene)는 프로모터 저메틸화(hypomethylation)에 의해 활성화될 수 있다.
· 최근 연구결과에 의하면 인헨서(enhancer) 부위에서의 DNA 메틸화가 표적 유전자 발현의 조절을 통해 암 발병에 있어서 매우 중요한 역할을 한다는 것이 보고되었다.
□ 연구내용
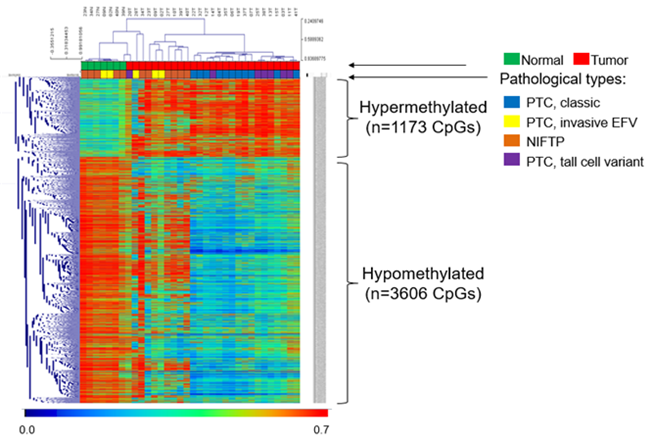
· 연구를 통해 갑상선암 특이적으로 변화하는 수천개의 뉴클레오타이드(CpG) 위치에서 DNA 메틸화 변화가 관찰되며, DNA 메틸화 변화는 유전자 발현에 영향을 주는 것을 확인하였다.
· 연구팀은 유전자의 프로모터 또는 인헨서 DNA에서의 메틸화 변화가 유전자 발현에 영향을 주어 갑상선암의 발생과 밀접한 관련이 있음을 밝혔으며, 경계성 종양과 악성 종양을 구분할 수 있는 신규 DNA 메틸화 바이오마커를 발굴하였다.
· 특히 MMP7, MICAL2, 및 DIAPH1 유전자의 DNA 메틸화가 악성 갑상선암에서 매우 감소하는 사실을 밝혔다.
♤ MMP7 (matrix metalloproteinjase-7) : MMP 유전자 그룹에 속하는 유전자로써, 암 형성 및 전이에 관여한다고 보고된 유전자
♤ MICAL2 (microtubule associated monooxygenase, calponin and lim domain containing 2) : 암세포 증식 및 상피간엽이행(epithelial-mesenchymal transition)을 촉진시킨다고 보고된 유전자
♤ DIAPH1 (diaphanous related formin-1) : 대장암의 전이와 관련성이 보고된 유전자
· 또한 갑상선암 특이적으로 DNA 과메틸화가 되는 부분은 TEAD family 전사 인자와 관련이 있으며, 반대로 저메틸화가 발생하는 부분은 Fra, JunB, Bach 등의 전사 인자와 관련이 있음을 밝혔다.
· 본 연구의 성과는 유전자의 프로모터 및 인헨서 DNA에서의 메틸화 변화가 유전자 발현에 영향을 주어 갑상선 발생에 밀접한 관련이 있음을 밝히고, 특히 MMP7, MICAL2, 및 DIAPH1 유전자의 DNA 메틸화가 악성 갑상선암에서 매우 감소하는 분자 바이오마커임을 알아냈다. 그러므로 이 분자 마커를 이용하여 악성 갑상선암의 진단 및 예후 판정을 위한 실용화 기술 개발에 기여할 것으로 기대된다.
□ 연구성과의 의미
▶ 갑상선암과 DNA 메틸화 변화의 관련성 규명
· 갑상선암 특이적으로 변화하는 수천개의 CpG 위치에서 DNA 메틸화 변화가 관찰되며, DNA 메틸화 변화가 유전자 발현에 영향을 주기 때문에 갑상선암 발생에 있어 DNA 메틸화가 매우 밀접한 관련이 있음을 보여주고 있다
· 또한, 갑상선암 특이적 DNA 과메틸화가 되는 부분은 TEAD family 전사 인자와 관련이 있으며, 반대로 저메틸화가 발생하는 부분은 Fra, JunB, Bach 등의 전사인자와 관련이 있음을 밝혔다.
▶ 경계성 종양과 악성 종양을 구분 지을 수 있는 DNA 메틸화 마커 발굴
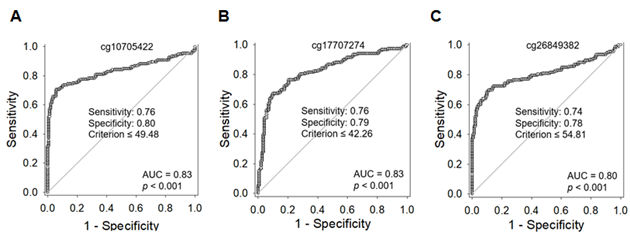
· 악성 갑상선암에서 MMP7, MICAL2, 및 DIAPH1 유전자에서 DNA 메틸화가 의미 있게 감소함을 대규모 환자 코호트 연구에서 입증하여 악성 갑상선암의 진단 및 예후를 판정하는 실용화 기술을 개발함으로써 갑상선암의 과잉 진단 및 이에 따른 불필요한 수술을 크게 줄여 환자 삶의 질 향상에 기여할 것으로 기대된다.
연구 결과 문답
이번 성과 뭐가 다른가
1. 유전자상의 프로모터 뿐만 아니라 인헨서 위치에서의 DNA 메틸화 변화가 갑성선암과 밀접한 관련이 있음을 규명
2. 갑상선암 특이적 신규 DNA 메틸화 마커를 규명
어디에 쓸 수 있나
■ 경계성 종양과 악성 종양을 구분할 수 있는 분자 마커로 활용하여, 갑상선암의 진단 및 예후에 활용될 수 있을 것이라고 기대함
실용화까지 필요한 시간은
■ 검증에 필요한 제품의 개발 속도 및 코호트 검증에 따라 실용화 소요시간이 결정될 것
실용화를 위한 과제는
■ 전향적인 임상시험을 통해 갑상선암 진단의 정확도를 검증하는 시도가 필요함.
연구를 시작한 계기는
■ 갑상선암에 대한 과다진단 및 과잉치료의 의료사회적 문제가 발생되고 있지만, 경계성 종양과 악성 종양을 명확히 구분할 수 있는 분자 마커가 거의 보고 되지 않아 연구를 시작하게 됨
에피소드가 있다면
■ 신규 발견된 DNA 메틸화 마커의 성능을 평가하기 위해 갑상선암의 다양한 아형에서 검증을 진행을 하였는데, 이때 임상 시료를 얻는 것이 어려웠음.
꼭 이루고 싶은 목표는
■ 다양한 유전체 기술을 활용한 분자마커 연구를 통해 분자 마커의 개발 및 활성화에 기여하고 싶음
신진연구자를 위한 한마디
■ 본 연구 성과는 코딩 RNAs 위치에 초점이 맞추어져 있는 기존연구를 벗어나기 위해, 인헨서 부위의 커버리지를 가지고 있는 최신 기술을 활용하였음. 새로운 기술이 개발되었을 때 남들보다 빠르게 연구 아이디어에 접목 시키는 것은 연구를 진행함에 있어서 중요한 하나의 요소라고 생각함
그림 및 용어 설명
1. DNA 메틸화와 유전자 발현과의 관계
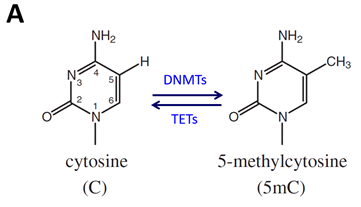
· 고등 동식물 유전자 염기서열에서 CG 라는 이중 뉴클레오티드가 많이 존재하며, 이 CG의 C (시토신)에 메틸기(CH3-)라는화학적 구조물이 환경에 따라 “결합”또는 “이탈”이 발생하는데, 이를 “메틸화”또는 “탈메틸화”한다고 부른다(그림 A).
· 특히 많은 유전자의 전사활성을 조절하는 프로모터 영역에는 CG 이중뉴클레티드가 집중적으로 분포하고 있으며, 이를 “CpG island”라고 부름(그림 B).
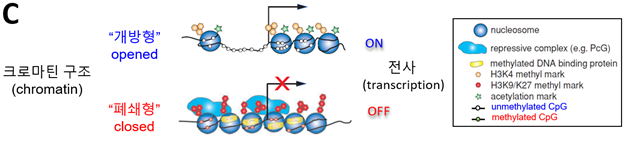
· CpG island에서 각CG의 의 C가 탈메틸화 상태이면 이를 프로모터 또는 크로마틴 구조가 열려 있다(“개방형”)고 부르며, 이와 반대로 각 CG의 C가 메틸화 상태이면 이를 프로모터 또는 크로마틴 구조가 닫혀 있다(“폐쇄형”)고 부른다(그림 C).
· 이러한 크로마틴구조의 변형은 DNA 메틸화와 DNA에결합되어 있는 단백질복합체인뉴클레오솜(nucleosome)의 일부 아미노산 표지자 특성과의 상호작용에 의해 결정된다(그림 C).
· 프로모터가 개방형일 때, 프로모터의 DNA 염기서열은전사인자 등의 단백질과의 결합을 통해 전사개시부위(TSS)로부터의 RNA가 합성이 진행되나, 이와 반대로 프로모터가 폐쇄형일 때, 프로모터에는 뉴클레오솜이 밀접되어 전사인자 등의 단백질의 접근 또는 결합을 억제해 RNA 합성을 진행하지 못하게 한다(그림 C).
2. 인헨서
· 유전자의 발현을 원거리에서 조절하는 DNA 영역이다.
· 활성 단백질이 표적 유전자의 인헨서에 결합하면 표적 유전자의 프로모터와 상호작용하여 표적 유전자를 활성화시킨다.
그림 설명
그림 1. 정상조직과 갑상선암 조직에서의 과메틸화(hypermethylated) 및 저메틸화(hypomethylated)가 발생하는 CpG들의 비교 분석
(A)
(B)
그림 2. 갑상선암 특이적 (A)과메틸화 및 (B)저메틸화가 영향을 주는 전사인자들
그림 3. 3종의 메틸화 바이오마커를 활용한 양성 종양, 경계성 종양 및 악성 종양 구분 성능 평가
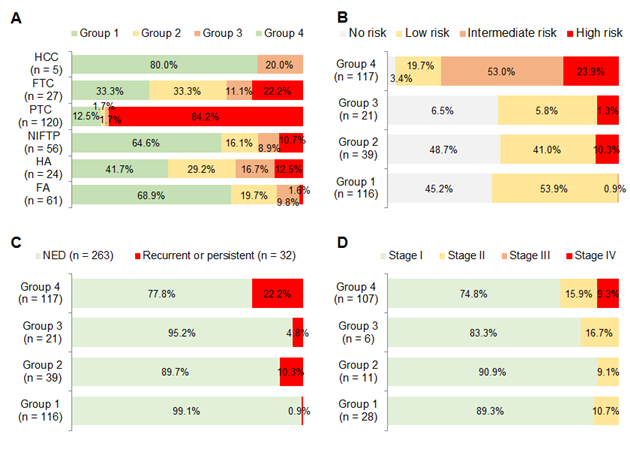
그림 4. DNA 메틸화 마커 3개의 메틸화 정도에 따른 4개 환자 그룹과 (A) 다양한 갑상선 종양 [양성 종양(FA), 경계성 종양(NIFTP), 저위험도 유두암종(IEFVPTC), 전형적 유두암종(classic PTC), 공격적 성향의 유두암종(TCVPTC)], (B) 갑상선종양의 수술 후 재발 예측 위험도, (C) 실제 재발 및 (D) 암 병기와의 연관성 분석
김용성 박사 이력사항
1. 인적사항
· 소 속 : 한국생명공학연구원
유전자교정연구센터
· 전 화 : 042-879-8110
· e-mail : yongsung@kribb.re.kr
2. 학 력
· 1976 - 1983 성균관대학교 생물학 이학사
· 1983 - 1985 성균관대학교 대학원 동물학 이학석사
· 1985 - 1988 성균관대학교 대학원 분자유전학 이학박사
3. 경력사항
· 1990 – 1993 한국생명공학연구원 (Post Doc)
· 1993 – 1994 일본 오사카대 (방문교수)
· 1994 – 현재 한국생명공학연구원 선임/책임연구원
· 2000 – 2003 한국생명공학연구원 유전체센터 (센터장)
· 2004 – 현재 과학기술연합대학원대학교 (교수)
· 2004 – 2006 충남대학교 의과대학 (겸임교수)
· 2006 – 2010 충남대학교병원 조직은행 운영위원회 (위원)
· 2012 – 2013 미국 UCSF Medical Center (방문교수)
· 2014 – 2016 한국생명공학연구원 유전체연구소 (소장)
· 2015 – 2018 제4기 국가생명윤리위원회 인체유래물전문위원회(위원)
· 2015 – 2019 대전고등검찰청 검찰시민위원회 (위원장)
· 2015 – 현재 국립중앙인체자원은행 분양심의위원회 (위원)
· 2019 – 현재 보건복지부 공용기관생명윤리위원회 (위원)
4. 전문 분야 정보
· 분자유전학
정찬권 교수 이력사항
1. 인적사항
· 소 속 : 가톨릭대학교 서울성모병원
병리과
· 전 화 : 02-2258-1622
· e-mail : ckjung@catholic.ac.kr
2. 학 력
· 1991 - 1997 경상대학교 의학과 학사
· 1998 - 2000 가톨릭대학교 대학원 병원병리학 의학석사
· 2001 - 2007 가톨릭대학교 대학원 병원병리학 의학박사
3. 경력사항
· 1997 – 1998 가톨릭중앙의료원 (인턴)
· 1998 – 2002 가톨릭중앙의료원 병리과 (레지던트)
· 2002 – 2005 공군항공우주의료원 (항공 군의관)
· 2005 – 현재 가톨릭대학교 서울성모병원 (교수)
· 2010 – 2011 미국 피츠버그대학교 (방문교수)
· 2012 – 2014 대한세포병리학회 정도관리이사/위원장
· 2015 – 2019 대한갑상선학회 윤리이사
· 2016 – 현재 대한암학회 이사
· 2019 – 현재 대한갑상선학회 재무이사
· 2019 – 현재 대한병리학회 간행이사/위원장
4. 전문 분야 정보
· 분자병리학, 내분비병리학, 골연부조직병리학, 디지털병리학, 세포병리학
박종열 박사 이력사항
1. 인적사항
· 소 속 : 한국생명공학연구원
유전자교정연구센터
· 전 화 : 042-879-8124
· e-mail : nlcguard@kribb.re.kr
2. 학 력
· 2000 - 2006 목원대학교 미생물학전공 학사
· 2007 - 2014 과학기술연합대학원 대학교 기능유전체학 박사
3. 경력사항
· 2014 - 2017 한국생명공학연구원 박사후연구원
· 2017 – 현재 한국생명공학연구원 객원선임연구원
4. 전문 분야 정보
· 후성유전체
 서울성모병원 병리과 정찬권 교수, 한국생명공학연구원과 공동연구 수행
서울성모병원 병리과 정찬권 교수, 한국생명공학연구원과 공동연구 수행 







 서울성모병원 병리과 정찬권 교수, 한국생명공학연구원과 공동연구 수행
서울성모병원 병리과 정찬권 교수, 한국생명공학연구원과 공동연구 수행 











