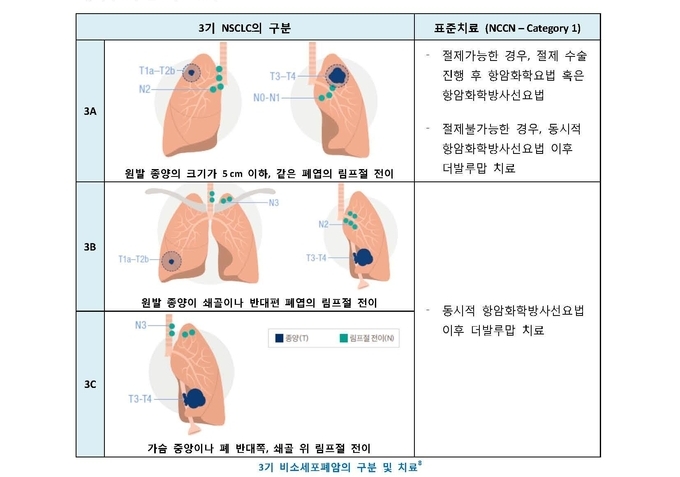
▪ 미국암종합네트워크(NCCN) 치료 지침을 통해 절제 불가능한 3기 비소세포폐암 치료에 유일하게 가장 높은 수준(category1)으로 권고
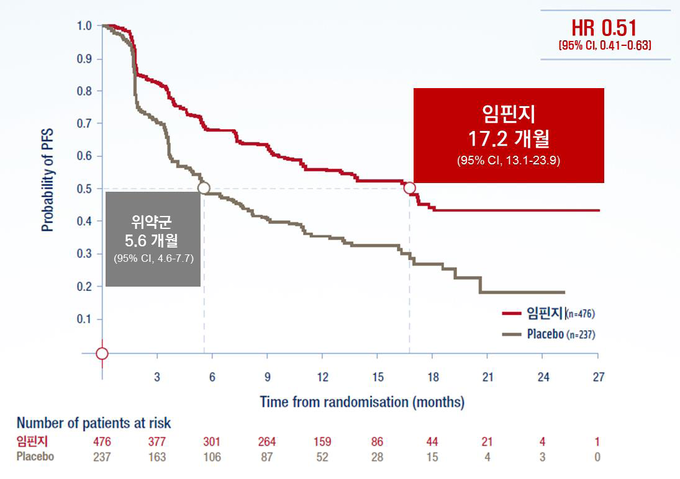
▪ PACIFIC 3상 임상을 통해 무진행 생존기간(PFS) 11.6개월 연장 및 사망위험(HR) 32% 감소 등 유의한 생존 개선 효과 확인
한국아스트라제네카㈜(대표이사 김상표)는 3기 비소세포폐암 치료에 승인된 최초의 면역항암제 임핀지(성분명: 더발루맙)의 국내 출시를 알리는 기자간담회를 개최하였다.
발표에서는 동시적 항암방사선요법(CCRT) 이후 질병이 진행되지 않은 절제 불가능한 국소 진행성(3기) 비소세포폐암 치료의 의의와 가치에 대해 소개했다.
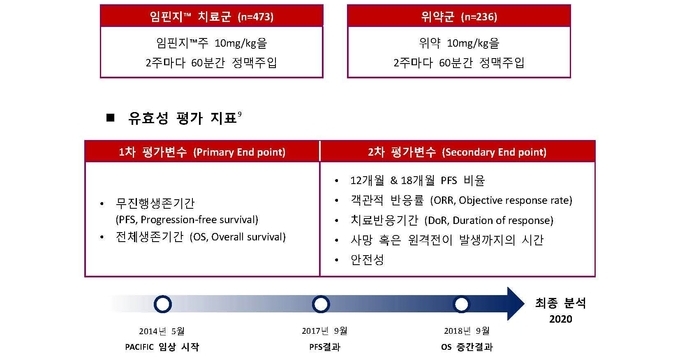
임핀지는 26개국 235개 기관에서 최소 2주기 이상 동시적 항암방사선요법(CCRT)을 받은 이후 질병 진행이 없었던 713명의 절제 불가능한 3기 비소세포폐암 환자를 대상으로 한 이중맹검, 무작위, 위약 대조 임상 3상이자, 뉴잉글랜드저널오브메디슨지(NEJM, New England Journal of Medicine)에 게재된 PACIFIC 연구 결과를 근거로, 2018년 12월 4일 식품의약품안전처로부터 국내 허가를 획득했다.
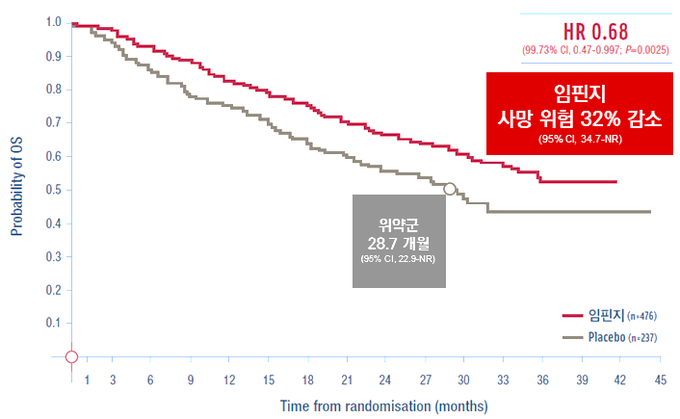
연구 결과, 임핀지 치료군의 무진행생존기간 중앙값(mPFS)은 17.2개월(95% CI, 13.1-23.9)로 위약 군 5.6개월(95% CI, 4.6-7.7) 대비 11.6개월 길게 나타났다(stratified HR 0.51; 95% CI, 0.41 to 0.63). 24개월 시점에서 임핀지 치료군의 전체생존율(OS rate)은 66.3%(95% CI, 61.7-70.4)로 위약 군 55.6%(95% CI, 48.9-61.8) 대비 유의한 개선을 보였다(two sided P=0.005). 사망 위험 또한 임핀지 치료군에서 위약 군 대비 32% 낮게 나타났다(stratified HR=0.68, 99.73% CI, 0.47-0.997; p=0.0025) [data cutoff: March 22, 2018].
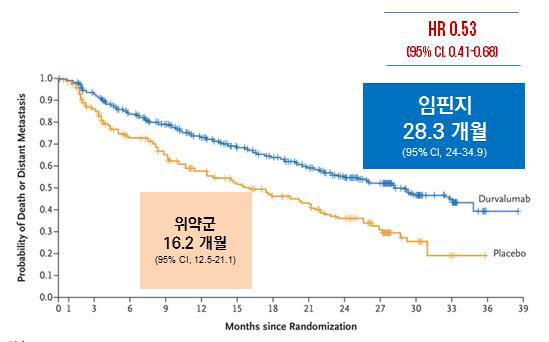
임핀지 치료군의 객관적 반응률(ORR)은 30.0%(95% CI, 25.8-34.5)로, 위약 군 17.8%(95% CI, 13.0-23.6) 대비 높았다.(p<0.001) [data cutoff: March 22, 2018].2 특히, 임핀지 치료군의 사망 혹은 원격전이 발생까지의 시간 중앙값은 28.3개월(95% CI, 24.0-34.9)로, 위약 군 16.2개월(95% CI, 12.5-21.1)에 비해 약 12개월 길게 나타났다(Stratified HR=0.53, 95% CI, 0.41–0.68)[data cutoff: March 22, 2018].
연세암병원 종양내과 조병철 교수는 “PACIFIC 연구는 모든 평가지표에서 표준요법 대비 의미 있는 개선을 나타냄으로써 향후 3기 비소세포폐암 패러다임을 바꿀 중요한 성과”라며 “이 결과를 바탕으로 미국종합암네트워크(NCCN)도 절제 불가능한 3기 비소세포폐암 환자에서 임핀지를 유일하게 가장 높은 수준(category)으로 권고1하고 있다”고 밝혔다.
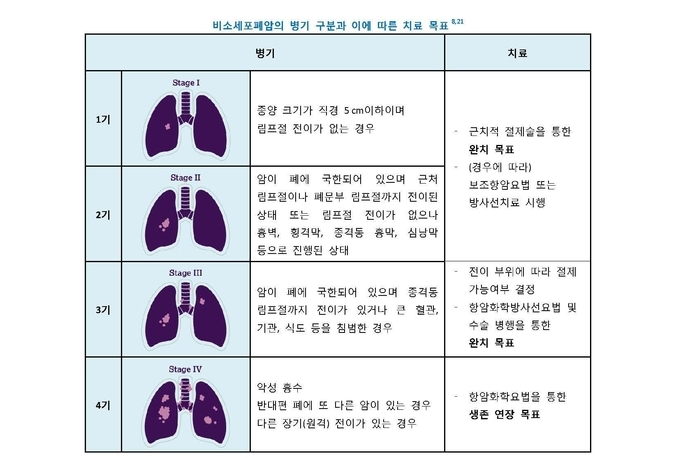
한편, 절제 불가능한 3기 비소세포폐암 환자의 대부분은 항암방사선 요법 이후 1년 이내에 전이나 재발을 겪고 있으며, 10명 중 8~9명의 환자는 4기로 진행된다. 또한 절제 불가능한 3기 비소세포폐암의 5년 생존율은 15%에 지나지 않아, 표준치료 이후 치료 이점이 있는 새로운 치료에 대한 의료진과 환자의 요구가 대두되어 왔다.
서울아산병원 종양내과 이대호 교수는 “비소세포폐암 3기는 치료 기간 연장을 목표로 하는 4기와 달리 완치를 기대할 수 있는 마지막 병기임에도, 지난 20년동안 표준치료보다 유의미한 생존 개선을 보인 치료제가 없어 안타까웠다”며 “항암방사선요법 이후 질병 진행 여부를 주기적으로 모니터링 하는 것 외에는 마땅한 치료 방법이 없어 마음을 졸여 온 의료진과 환자들에게 임핀지가 새로운 희망을 줄 수 있을 것”이라고 기대했다.
임핀지는 환자의 몸무게에 따라 10 mg/kg을 2주 간격으로 60분에 걸쳐 정맥 주사하며, 질환이 진행되거나 허용 불가능한 독성 발생 전까지 투여한다. 임핀지 투약 시 가장 흔하게 발생한 이상사례는 기침(40.2%, 위약 군 30.3%), 상부 호흡기 감염(26.1%, 위약 군 11.5%) 및 발진(21.7%, 위약 군 12.0%)이었다. 3 또는 4등급 이상사례의 발생률은 이 약 투여군에서 12.8%, 위약군에서 9.8%이었다. 가장 흔한 3 또는 4등급 이상사례는 폐렴(6.5%, 위약 군 5.6%) 이었다.
* 임핀지™에 대하여
임핀지™는 절제불가능한 3기 비소세포폐암(NSCLC, non-small cell lung cancer) 환자의 치료에 있어 생존개선효과가 확인된 최초이자 유일한 면역항암치료제다.4
3기 NSCLC 환자에서 최초로 유효성을 입증하고 안전성을 확인한 3상임상시험 PACIFIC 연구2를 기반으로, 지난 2018년 12월 ‘백금기반동시항암방사선요법 이후 질병이 진행되지 않은 절제불가능한 국소진행성(3기) 비소세포폐암 환자의 치료’를 적응증으로 식품의약품안전처의 허가를 획득했다.4
미국종합암네트워크(NCCN)에서 절제불가 3기 NSCLC 치료에 유일하게 권고하고 있는 유일한 표준요법1으로, 미국, 유럽을 포함한 10개 이상 국가에서 승인되어 사용되고 있다.
References
1 NCCN (2019) NCCN Guidelines for NSCLC Version3. 2019.
3 Antonia, S. J., Villegas, A., Daniel, D., Vicente, D., Murakami, S., Hui, R., ... & Cho, B. C. (2017). Durvalumab after chemoradiotherapy in stage III non–small-cell lung cancer. New England Journal of Medicine, 377(20), 1919-1929.
4 식품의약품안전처, <임핀지™ 허가사항>, 2018.12.
5 Albain KS, Swann RS, Rusch VW, et al. Radiotherapy plus chemotherapy with or without surgical resection for stage III non-small-cell lung cancer: a phase III randomised controlled trial. Lancet. 2009;374(9687):379-386.
6 Senan, Suresh, et al. "PROCLAIM: Randomized phase III Trial of pemetrexed-cisplatin or etoposide-cisplatin plus thoracic radiation therapy followed by consolidation chemotherapy in locally advanced nonsquamous non–small-cell lung cancer." Journal of Clinical Oncology 34.9 (2016): 953-962.
7 Bradley, Jeffrey D., et al. "Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617): a randomised, two-by-two factorial phase 3 study." The Lancet Oncology 16.2 (2015): 187-199.
8 Ahn, Jin Seok, et al. "Multinational randomized phase III trial with or without consolidation chemotherapy using docetaxel and cisplatin after concurrent chemoradiation in inoperable stage III no n–small-cell lung cancer: KCSG-LU05-04." Journal of Clinical Oncology 33.24 (2015): 2660-2666.1
9 Carter, Dennis L., et al. "A Randomized Phase III Trial of Combined Paclitaxel, Carboplatin, and Radiation Therapy Followed by Weekly Paclitaxel or Observation for Patients With Locally Advanced Inoperable Non–Small-Cell Lung Cancer." Clinical Lung Cancer 13.3 (2012): 205-213.
10 Movsas, Benjamin, et al. "Randomized phase II trial of cisplatin, etoposide, and radiation followed by gemcitabine alone or by combined gemcitabine and docetaxel in stage III A/B unresectable non-small cell lung cancer." Journal of Thoracic Oncology 5.5 (2010): 673-679.
11 Gandara, David R., et al. "Long-term survival with concurrent chemoradiation therapy followed by consolidation docetaxel in stage IIIB non–small-cell lung cancer: a phase II Southwest Oncology Group study (S9504)." Clinical Lung Cancer 8.2 (2006): 116-121.
12 Hanna, Nasser, et al. "Phase III study of cisplatin, etoposide, and concurrent chest radiation with or without consolidation docetaxel in patients with inoperable stage III non–small-cell lung cancer: the Hoosier Oncology Group and US Oncology." Journal of Clinical Oncology 26.35 (2008): 5755-5760.
13 Fournel, Pierre, et al. "Randomized phase III trial of sequential chemoradiotherapy compared with concurrent chemoradiotherapy in locally advanced non-small cell lung cancer." Journal of Clinical Oncology 23 (2005): 5910-5917.
14 Vokes, Everett E., et al. "Induction chemotherapy followed by chemoradiotherapy compared with chemoradiotherapy alone for regionally advanced unresectable stage III non–small-cell lung cancer: Cancer and Leukemia Group B." Journal of Clinical Oncology 25.13 (2007): 1698-1704.
15 Wozniak, Antoinette J., et al. "A pilot trial of cisplatin/etoposide/radiotherapy followed by consolidation docetaxel and the combination of bevacizumab (NSC-704865) in patients with inoperable locally advanced stage III non–small-cell lung cancer: SWOG S0533." Clinical Lung Cancer 16.5 (2015): 340-347.
16 Butts, Charles, et al. "Tecemotide (L-BLP25) versus placebo after chemoradiotherapy for stage III non-small-cell lung cancer (START): a randomised, double-blind, phase 3 trial." The Lancet Oncology 15.1 (2014): 59-68.
17 Auperin A, Le Pechoux C, Rolland E, et al. Meta-analysis of concomitant versus sequential radiochemotherapy in locally advanced non-small-cell lung cancer. J Clin Oncol. 2010;28(13):2181-2190.
18 US FDA. US Imfinzi (durvalumab) prescribing information. February 2018.